
呼吸机是一种能改变、控制或代替人的正常生理呼吸,改善呼吸功能,增加肺通气量,减轻呼吸功消耗,节约心脏储备能的装置。它的作用是能够起到预防和治疗呼吸衰竭、减少并发症、挽救及延长病人生命等重要作用,已普遍用于治疗各种原因所致的呼吸衰竭、大手术期间的麻醉呼吸管理、呼吸支持治疗和急救复苏等方面。
下面,请跟发布君逐一了解呼吸机的国内外技术法规。

呼吸机介绍
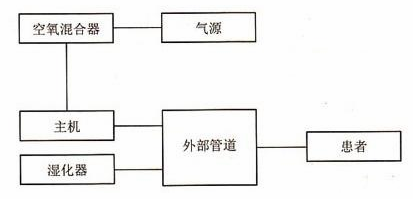
呼吸机主要由涡轮、泵、阀门、芯片、传感器等构成,组成结构相对简单,但是要求却很高。其中涡轮、阀门、传感器(流量传感器、湿度传感器和压力传感器)等关键部件以进口为主。

呼吸机结构图
呼吸机有多种不同的分类方式,按照不同的分类方式,呼吸机有着不同的名称。按照应用环境来讲,呼吸机分为医用呼吸机和家用呼吸机。医用呼吸机用于在医护人员的监控下,供呼吸衰竭和气压性创伤患者以及需要呼吸支持、呼吸治疗及急救复苏的患者使用。主要有:治疗呼吸机、呼吸机、急救呼吸机、院外转运呼吸机、高频喷射呼吸机、高频振荡呼吸机等。家用呼吸机用于缓解病人睡眠过程中的打鼾、低通气和睡眠呼吸暂停,中轻度呼吸衰竭和呼吸功能不全者,从而达到辅助治疗目的,通常用于家庭环境,也可用于医疗机构。主要有:家用呼吸支持设备、睡眠呼吸机、睡眠无创呼吸机、持续正压呼吸机、双水平无创呼吸机、正压通气治疗机等。
①医用呼吸机

② 家用呼吸机
按照连接方式可分为有创呼吸机和无创呼吸机。有创呼吸机,就是指通过建立人工气道(经鼻或经口气管插管、气管切开)进行的正压机械通气方式,无创呼吸机是指通过口鼻罩、鼻罩、鼻管等方式建立正压机械通气方式。
① 有创呼吸机
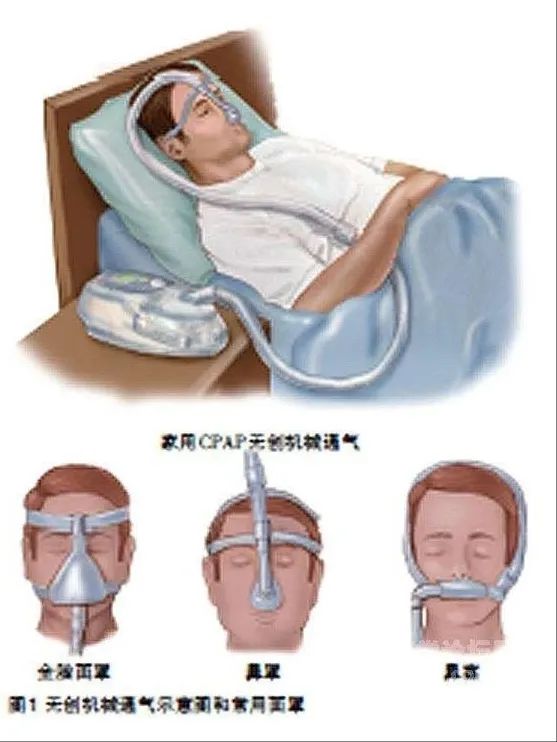
② 无创呼吸机
另外,按照用途可分为麻醉呼吸机、急救呼吸机、高频呼吸机、小儿呼吸机和无创呼吸机等。按照驱动方式可分为气动气控呼吸机、气动电控呼吸机和电动电控呼吸机等。按照通气模式可分为定时通气机、定容通气机、定压通气机和定流通气机等。

中外呼吸机技术法规对比
1.国内法规

我国医疗器械采取分类管理,共分为三类。呼吸机在我国属于二类/三类医疗器械,是由省一级/国务院食品药品监管部门实施注册管理。其中属于二类医疗器械的呼吸机有家用呼吸支持设备(非生命支持)、睡眠呼吸暂停治疗设备、与呼吸机配套使用的呼吸面罩、医用呼吸道湿化器、食道气管插管;属于三类医疗器械的呼吸机有治疗呼吸机(生命支持),急救和转运用呼吸机,高频呼吸机,家用呼吸机(生命支持)。
我国呼吸机的标准

中国医疗注册号可以通过国家药监局网站查询。
网址:www.nmpa.gov.cn
2.美国法规

常见的呼吸机在美国FDA属于II类医疗器械,需要按照510K来申请。510k文件是向FDA递交的上市前申请文件,目的是证明所申请上市的产品和已在美国市场上合法销售的产品在安全性和有效性方面比较是实质相等的,即为等价器械(substantially equivalent)。申请者必须把申请上市的器械与现在美国市场上一种或多种相似器械对比,得出并且支持等价器械的结论。对FDA 510k注册文件所必须包含的信息,FDA有一个基本的要求,其内容有16个方面。
美国的呼吸机基本要求有:保护接地、功能接地和电位均衡;电介质强度;机械强度;进液;危险输出的防止;电磁兼容;报警声音。
美国标准包括:ANSI/ASTM/IEC 60601.2.12-2009 《医用电气设备 第2-12部分:肺呼吸机的特殊安全性要求.ASTM国际标准容许偏差的重症监护呼吸机》ANSI/ASTM/ISO 10651-4-2002 《医用肺呼吸机 第4部分:操作员控制用人工呼吸机的特殊要求》ANSI/ASTM/ISO 10651-5-2006 《医用肺呼吸机 基本安全和基本性能的特殊要求.第5部分:气动急救人工呼吸器》ANSI/NFPA 1981-2006 《救火和急救服务用开路自持呼吸机标准》ASTM ANS/IEC 60601-2-12-2001 《医用电气设备 第2-12部分:呼吸机安全特定要求-急救用呼吸机-经ASTM国际批准作为带差异的美国国家标准》ASTM ANS/IEC 60601.2.12-2001 《医疗电气设备 第2-12部分; 肺通气器安全特别要求—关键护理呼吸机通过美国国家标准认证,偏差符合ASTM国际标准》ASTM ANSI/ISO 10651-4-2002 《呼吸机》ASTM ANSI/ISO 10651-5-2006 《医用呼吸机 基本安全和基本性能的特定要求》

已获得美国FDA准入的呼吸机可以通过其官网查询注册证书号。网址:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm

3.欧盟法规

欧盟将呼吸机作为Ⅱ类医疗器械管理。(医疗器械分为三大类,Ⅰ类(包含Ⅰ和Ⅰ*)、Ⅱ类(包含Ⅱa, Ⅱb)及Ⅲ类),出口欧盟都需要申请CE认证,且呼吸机的CE认证需要满足MDD指令,即医疗器械指令。企业需要先完成CE文件并提交通过审核后方进行体系审核,最终拿到CE证书和符合欧盟标准的体系证书。
欧盟标准包括:EN 794-3-2009 《肺呼吸机 第3部分:紧急呼吸机和运输呼吸机的特殊要求》EN ISO 80601-2-12-2011 《医用电气设备 第2-12部分:危重护理呼吸机的基本安全和基本性能专用要求》EN ISO 80601-2-72-2015 《医疗电气设备 第2-72部分:对呼吸机依赖患者的家庭医疗保健环境通风机基本安全和基本性能的特殊要求》(ISO 80601-2-72-2015)EN 14048-2002 《包装 测定在气化介质中包装材料的最终氧化生物降解性 封闭式呼吸机氧量测量方法》EN 14529-2005 《呼吸保护装置 逃生用包含由需求阀控制的正压呼吸器的带半罩式面具的自持式开路压缩空气呼吸机》EN 60601-2-12-2006 《医用电气设备 肺呼吸机安全性特定要求.第2-12部分:危急护理呼吸机》

查询是否具备欧盟医疗器械指令MDD 93/42/EEC或MDR医疗器械法规(EU) 2017/745的认证资质,可以通过链接https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=notifiedbody.main查询出具CE认证证书的机构是否是欧盟公告的认证机构,也就是说是验证证书出具机构的真伪,然后证书的真伪需要到出具认证证书的机构进行查询。
4.其他主要国家法规

(1)日本。如果需要投放市场产品必须满足日本的Pharmaceutical and Medical Device Act (PMD Act),在PMD Act的要求下,TOROKU注册系统要求国外的制造商必须向PMDA注册制造商信息。
(2)韩国。韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association,必须提前备案进口资质。
(3)澳大利亚。澳大利亚已与欧盟达成互认协议。这意味着,由TGA颁发的合格评定证书也被欧盟认可,TGA也认可欧盟CE认证。已获CE认证的用户,可提交CE证书及相关资料,获得TGA证书。

中国与欧美呼吸机基本要求对比
将我国与欧盟的呼吸机标准基本要求中指标进行对比,其中欧盟和美国标准都采标自国际标准IEC 60601-1:2005,IEC 60601-1-2:2014,故要求无大差异,而中国标准采标自国际标准IEC 60601-1:1998,标准版本旧,且无IEC 60601-1-2的对应标准,故与欧美标准差异较大。欧美的标准要求更加详细,更加严格。电气产品的不同,供电电源的差别,电压和频率导致设备的测试电压不同;EMC测试环境的要求也不同;报警声音的要求不同。
指标对比

供稿/ 广州海关
审核/ 海关总署商品检验司
监制/ 陶永
审校/ 刘畅
编辑/ 雷煦
美术编辑/ 卫昊

| 留言与评论(共有 0 条评论) “” |