仅供医学专业人士阅读参考

快来学习!
随着免疫、靶向治疗改变了肺癌诊疗格局,新辅助免疫、靶向治疗在非小细胞肺癌(NSCLC)领域取得了长足发展。2022年国际肺癌研究协会(IASLC)世界肺癌大会(WCLC)落下帷幕,“医学界肿瘤频道”特精选相关焦点研究,以飨读者。
精彩提要:
1.NADIM II研究重磅更新!新辅助化免联合治疗为可切除IIIA/B期NSCLC带来生存获益!
2.如何找出NADIM试验中非完全病理缓解的高进展风险患者?肿瘤Bulk-RNA Seq检测!
3.TOGATHER and better!特瑞普利单抗+含铂双药化疗新辅助治疗潜在可切除NSCLC安全高效!
4.irAE预示“重生”之机?特瑞普利单抗+含铂双药化疗新辅助治疗IIB-IIIB期NSCLC的Renaissance研究新启示
5.EGFR突变IIIA期NSCLC新辅助化免联合治疗的中国“答案”!ANSWER研究:阿美替尼vs厄洛替尼
6.“首个HER2+NSCLC药物”进军NSCLC新辅助治疗领域!实战一例直观“神药”效果!
Progression Free Survival and Overall Survival in NADIM II Study
▌ NADIM II研究:无进展生存期(PFS)和总生存期(OS)结果
(摘要号:PL03.12)
在NADIM试验中,新辅助化免联合治疗已被证实对可切除IIIA期NSCLC非常有效。本次大会更新了NADIM II随机试验的结果。
NADIM II(NCT03838159)是一项开放标签、随机、双臂、II期、多中心临床试验。ECOG PS 0-1,且无已知EGFR/ALK突变的可切除IIIA期(根据AJCC第7版)NSCLC患者,以2:1的比例随机分为两组:联合治疗组接受纳武利尤单抗360mg+紫杉醇200mg/m2+卡铂AUC 5,每21天(+/-3天)为1周期,共3周期作为新辅助治疗;单独化疗组接受紫杉醇200mg/m2+卡铂AUC 5,每21天(+/-3天)为1周期,共3周期;随后进行手术。经病理学评估证实的R0切除患者在手术后第3至8周(+7天)内开始纳武利尤单抗(480 mg Q4W)辅助治疗,为期6个月。主要终点为病理完全缓解(pCR),次要终点包括PFS、OS和生物标志物分析。
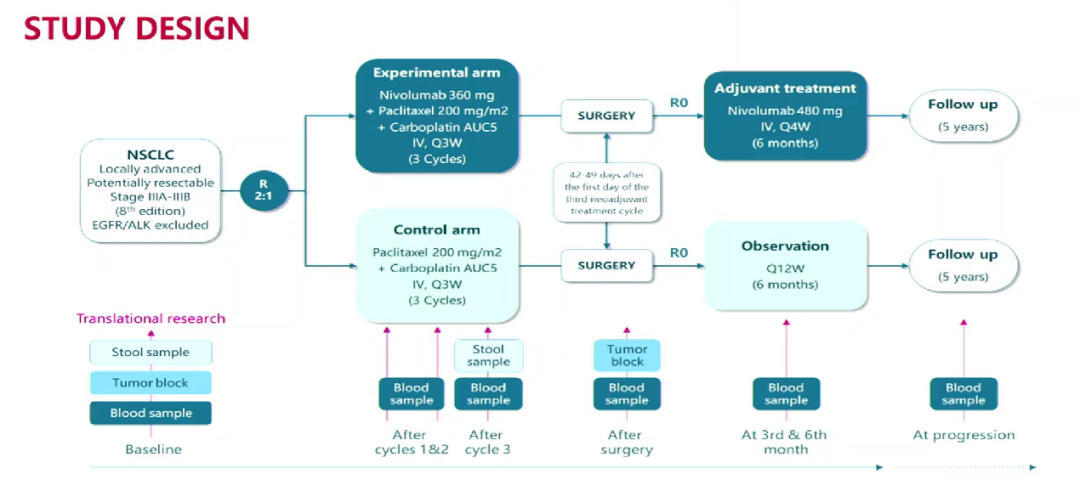
试验设计
结果显示,联合治疗组和单独化疗组分别有93.0%和69.0%的患者进行了最终手术。在所有患者中,11.0%的患者接受了全肺切除术,78.1%接受了肺叶切除术,6.8%接受了双肺叶切除术,2.7%接受了肺段切除术,1.4%接受了右下肺叶切除和肺段切除术。联合组中92.5%的患者接受了R0切除术,单用化疗组则为65.0%。
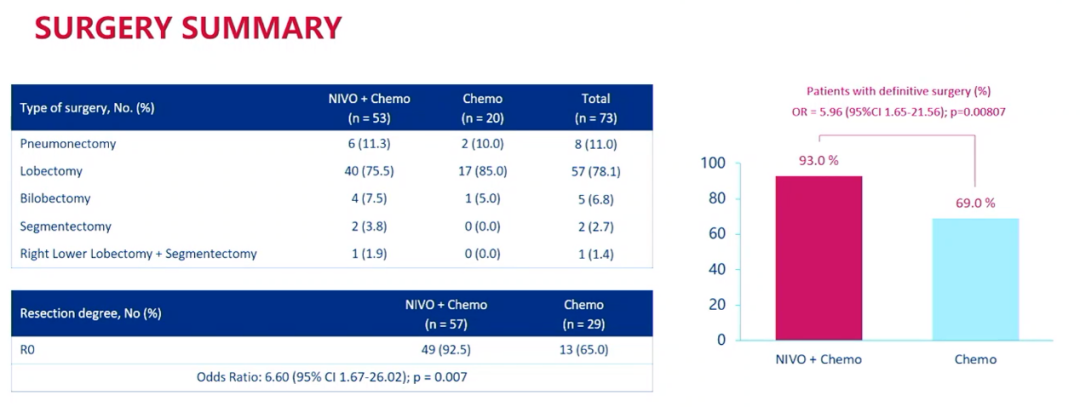
手术情况概览
此外,联合治疗组的降期率为69.8%,而单独化疗组为40.0%。
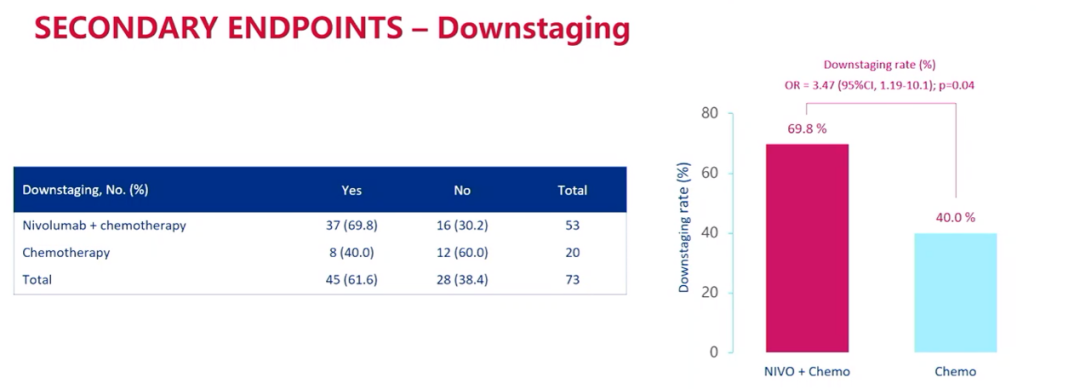
降期数据
经过26.1个月的中位随访时间,联合治疗组和单独化疗组的患者24个月PFS率分别为66.6%和42.3%。联合治疗组未达到中位PFS,而单独化疗组的中位PFS为18.3个月,(HR=0.48;95%CI:0.25-0.91;P=0.025)。
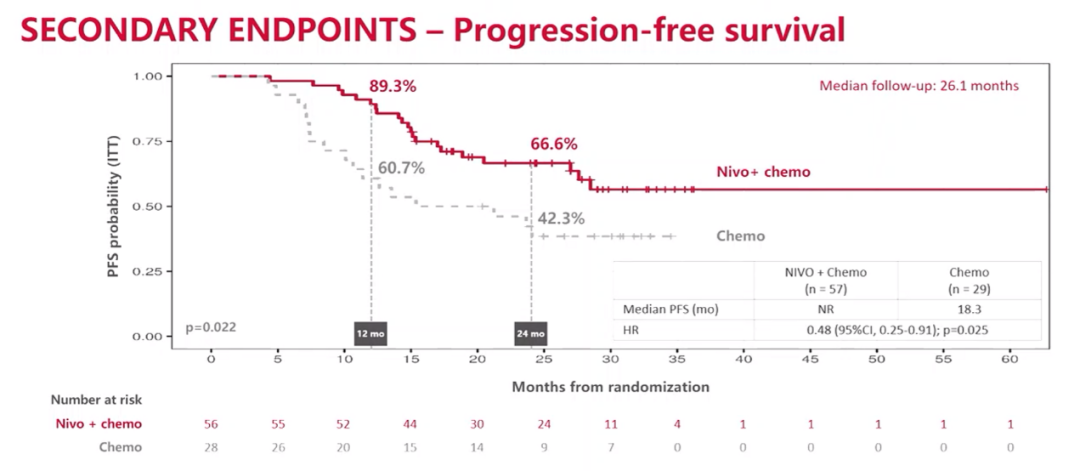
PFS结果
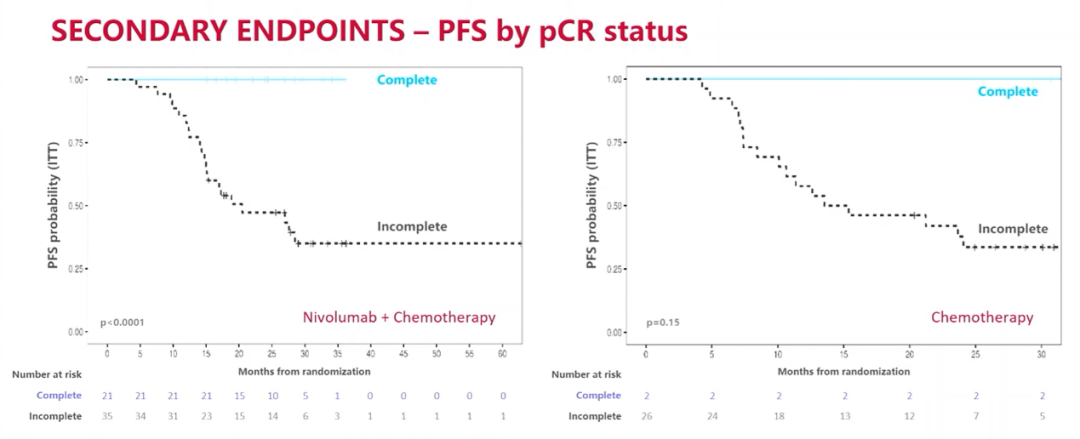
根据pCR状态对PFS的分析结果
联合治疗组和单独化疗组的24个月OS率分别为84.7%和63.4%,两组均未达到中位OS(HR=0.40;95%CI 0.17-0.93;P=0.034)。
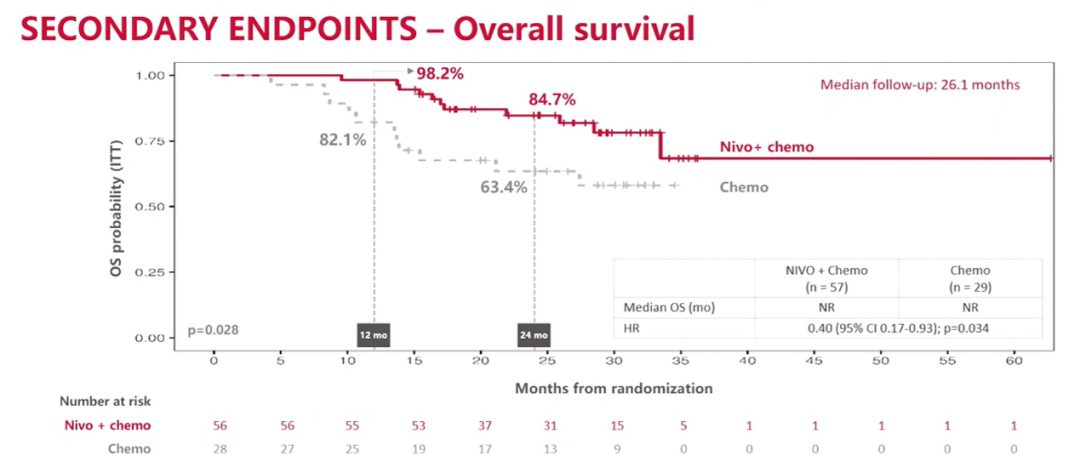
OS结果
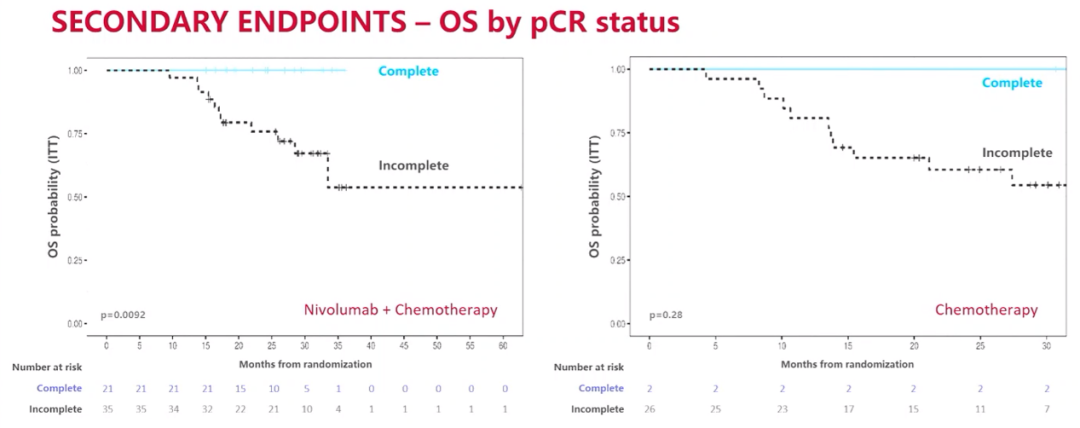
根据pCR状态对OS的分析结果
NADIM ll研究的最新生存数据证实了纳武利尤单抗联合铂类化疗新辅助治疗可切除IIIA期NSCLC的疗效。这种益处在肿瘤PD-L1表达阳性和实现pCR的患者中尤其明显。NADIM II研究也是化免联合新辅助治疗在可切除IIIA-B期NSCLC患者中显示出OS获益的首个临床研究。
Tumor Bulk-RNA Seq Identifies Patients at High Risk of Progression in Non-complete Pathological Responders from NADIM Trial
▌ 肿瘤Bulk-RNA Seq检测可识别NADIM试验中非完全病理缓解高进展风险患者
(摘要号:OA02.03)
病理缓解被认为是新辅助化免疫治疗患者生存的替代指标。从这个意义上讲,非完全病理缓解(non-CPR,非CPR)患者的疾病进展风险高于完全病理缓解(CPR)患者。为确定可能影响这一高危人群长期预后的基因表达模式,本研究检测了非CPR患者的手术标本,并分析了进展者和非进展者间的差异。
研究者分析了NADIM试验中可切除IIIA期NSCLC患者的手术组织样本。使用针对395个与免疫过程相关基因的Oncomine Immune Response panel,对肿瘤RNA进行测序。使用DESeq2和基因集富集分析(Gene Set enrichment analysis,GSEA)评估组间差异表达基因(DEG)和通路富集分析,并利用CIBERSORTx法估计免疫细胞亚型的比例。患者被分为CPR(n=22)和非CPR(n=14)两组。根据诊断后34.2个月是否有疾病进展,非CPR患者进一步被分为进展者(P,n=5)或非进展者(NP,n=9)。根据ROC曲线分析中似然比最高值作为阈值,将每位患者的DEG或免疫细胞亚群分为高或低组。
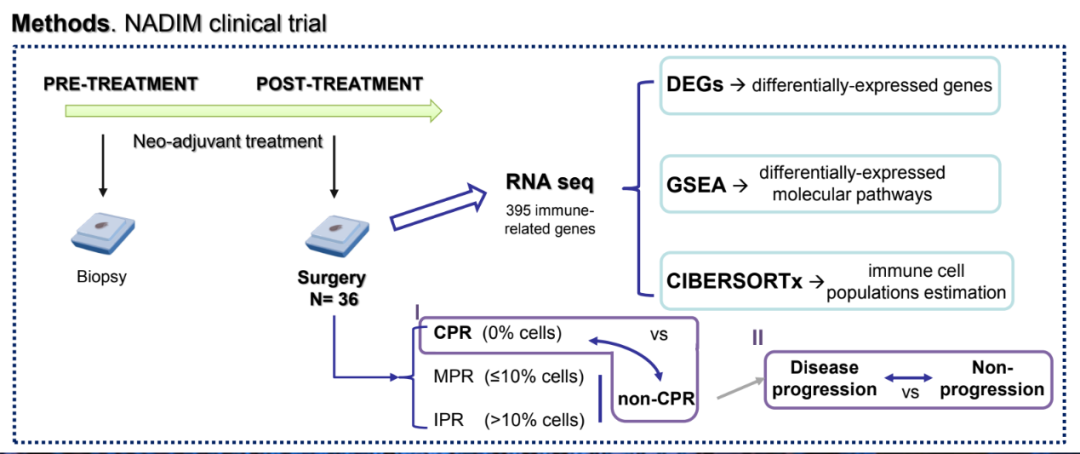
试验设计
结果显示,与CPR患者相比,非CPR患者中有22个基因表达上调,其中大多数基因与增殖(CDKN3、CCNB2、KIAA0101、MKI67、BUB1、CDK1、TOP2A、FOXM1、MELK、MAD2L1)、肿瘤标志物(CDKN2A、KRT5、BRCA1、TWIST1)及其他(MAGEA3、CEACAM1、CXCL8、TNFRSF18、G6PD、HMBS、DGAT2、ISG15)有关。
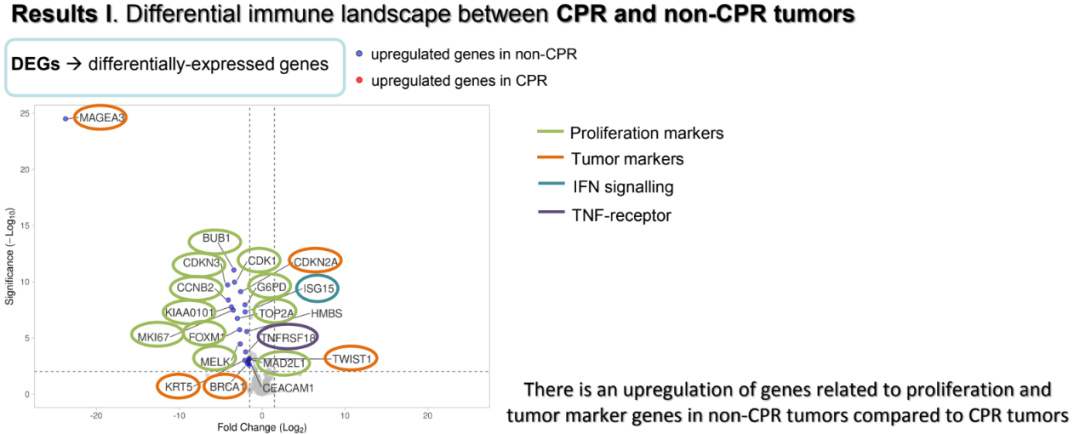
CPR与非CPR患者基因表达差异
进一步的GSEA分析显示,在CPR患者中,与抗原加工、TCR共表达和淋巴细胞浸润相关的通路上调。而非CPR患者表现出增殖、肿瘤标志物、干扰素、管家基因和肿瘤抗原信号相关通路的上调。在P和NP的差异方面,发现P患者中有10个基因差异上调:参与干扰素信号转导的IFI6和OAS3;作为肿瘤标志物的AKT和KRT7;参与I型干扰素信号转导的BST2、ISG15和IFI27以及CD8B、SDHA、HMBS和OAS1。
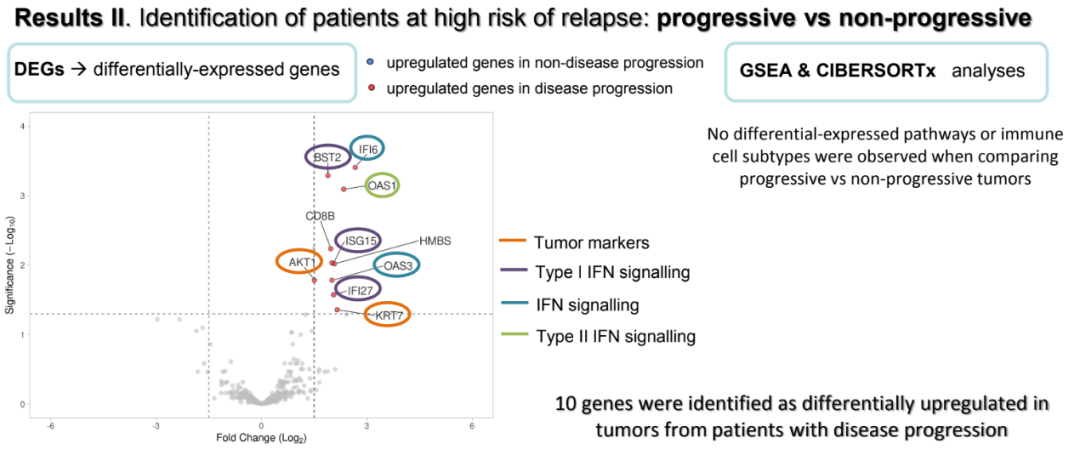
进展者与非进展者的基因表达差异(10种基因)
非CPR患者治疗后样本中较高水平的IFI6(p=0.010)、BST2(p=0.010)、CD8B(p=0.019)、AKT(p=0.033)、OAS3(p=0.010)和IFI27(p=0.010)与较短的PFS相关。此外,较高的HMBS(p=0.018)和AKT(p=0.003)水平与较短的OS相关。高AKT表达的患者进展(HR=10.31;95%CI 1.2-88.8)和死亡(HR=50.6;95%CI 3.77-680.5)风险显著更高。高AKT表达患者的中位PFS为12.3个月(95%CI 0-32.6),而低表达患者的中位PFS未达到。P和NP患者的估计细胞比例无差异。而非CPR患者中树突状细胞或中性粒细胞的活化比例较高,PFS(p=0.019,p=0.053)和OS(p=0.033,p=0.003)均较低。
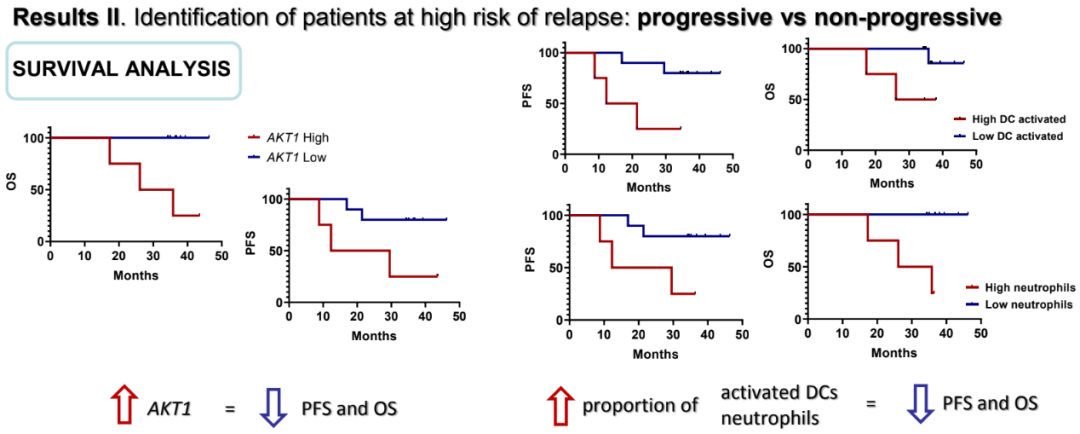
进展者与非进展者的特征性生存分析
研究表明,CPR患者手术标本相关信号通路表达的上调,表明PD-1抑制剂治疗可产生有效的免疫反应。此外,在非CPR患者手术标本中发现的与疾病进展相关的免疫表达特征,可能有助于这部分高危患者的随访和管理。
An Updated Analysis of Toripalimab and Platinum-Doublet Chemotherapy as Neoadjuvant Therapy for Potentially Resectable NSCLC
▌ 特瑞普利单抗联合含铂双药化疗新辅助治疗潜在可切除NSCLC患者的数据更新(TOGATHER研究)
(摘要号:2290/EP05.02-021)
PD-1/PD-L1抑制剂作为新辅助治疗在IB-IIIA期非小细胞肺癌(NSCLC)患者中显示出良好的抗肿瘤活性。III期NSCLC具有高度异质性,临床治疗方案仍存在争议。本前瞻性、单臂、II期研究,旨在探讨特瑞普利联合含铂双药化疗新辅助治疗潜在可切除NSCLC初治患者的疗效、安全性和可行性。本研究初步结果已于2021 WCLC中公布,本次会议公布了更新数据。
该研究纳入了非驱动基因突变IIIA-IIIB潜在可切除的NSCLC患者。所有患者在术前均接受2-4个周期的特瑞普利单抗(240 mg d1)、白蛋白紫杉醇(260 mg/m2 d1)(非鳞状细胞癌:培美曲塞500mg/m2 d1)和卡铂(AUC 5 d1)或顺铂(75mg/m2 d1),每3周一次。新辅助治疗完成后3-5周内进行术前影像学评估和手术指征评估。术后30天内,给予2个周期的辅助性特瑞普利单抗加化疗,随后给予13个周期(240 mg,Q3W)特瑞普利单抗单药治疗。主要终点为R0切除率。次要终点为pCR、主要病理缓解(MPR)、无病生存(DFS)和安全性。
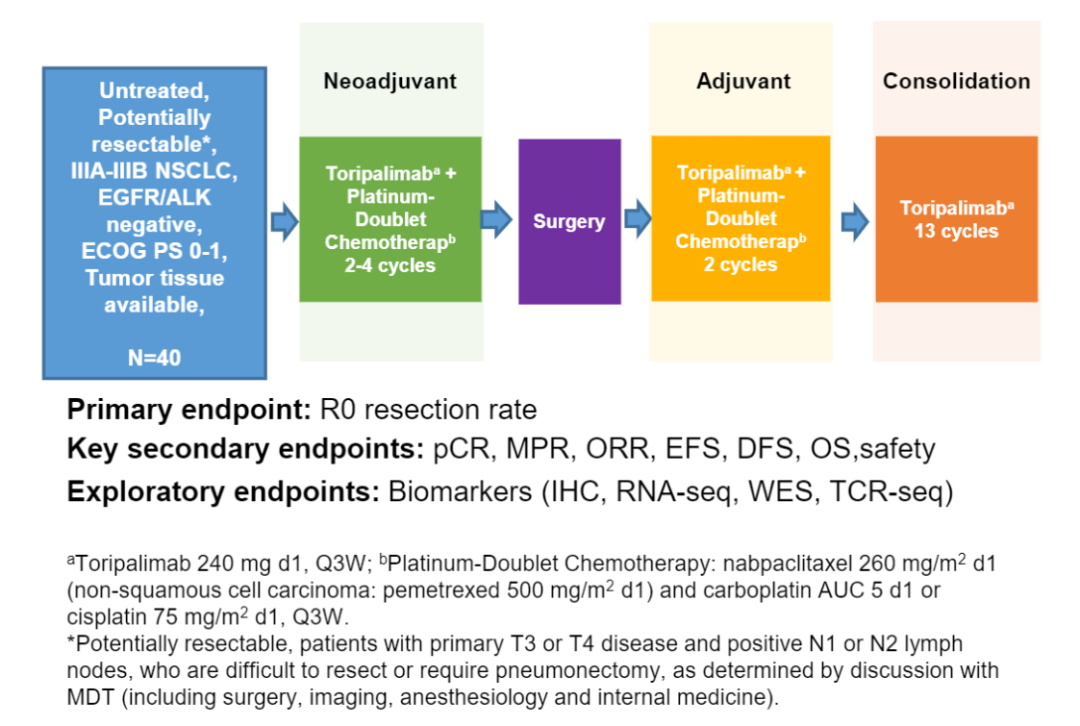
TOGATHER研究设计
截至2022年3月15日,共筛查了40例III期潜在可切除NSCLC患者,其中7例仍在接受新辅助治疗。在33名可评估患者中,中位年龄为58岁,12.1%为女性,18.2%为非吸烟者。鳞状细胞肺癌占87.9%(29/33),IIIB期占45.5%(15/33)。
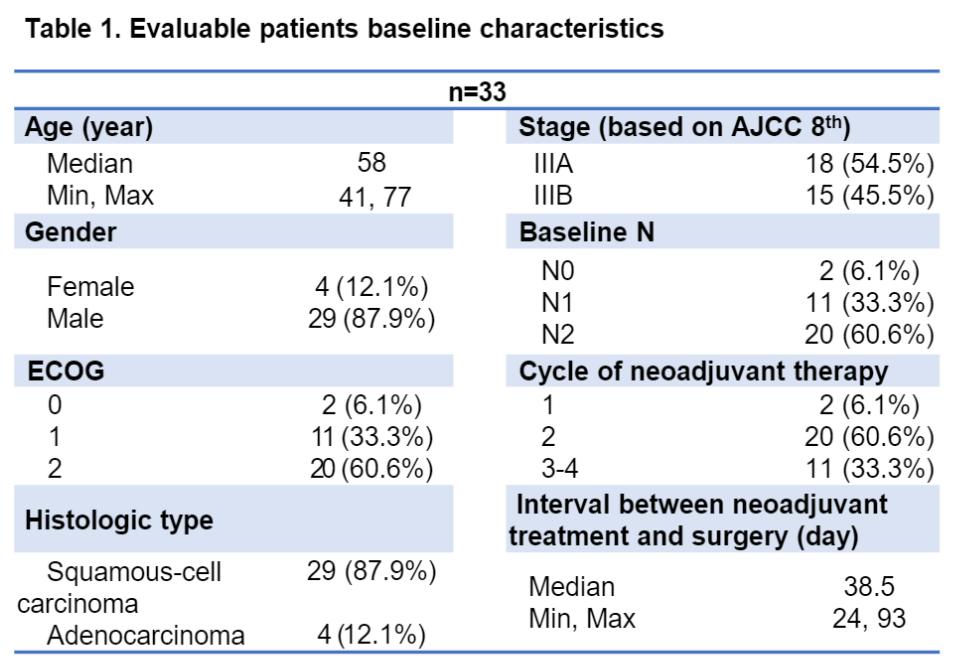
可评估患者基线特征
在可评估患者中,30名(90.9%)符合手术标准。其中4名患者因经济因素和个人原因而拒绝手术。所有26例接受手术的患者均实现了R0切除。实际手术率为78.8%(26/33),MPR为57.7%(15/26),pCR为42.3%(11/26)。在手术人群中,中位随访时间为16个月(范围:3-28),1年和2年DFS率分别为89.4%和72.9%。未观察到新的非预期不良事件。
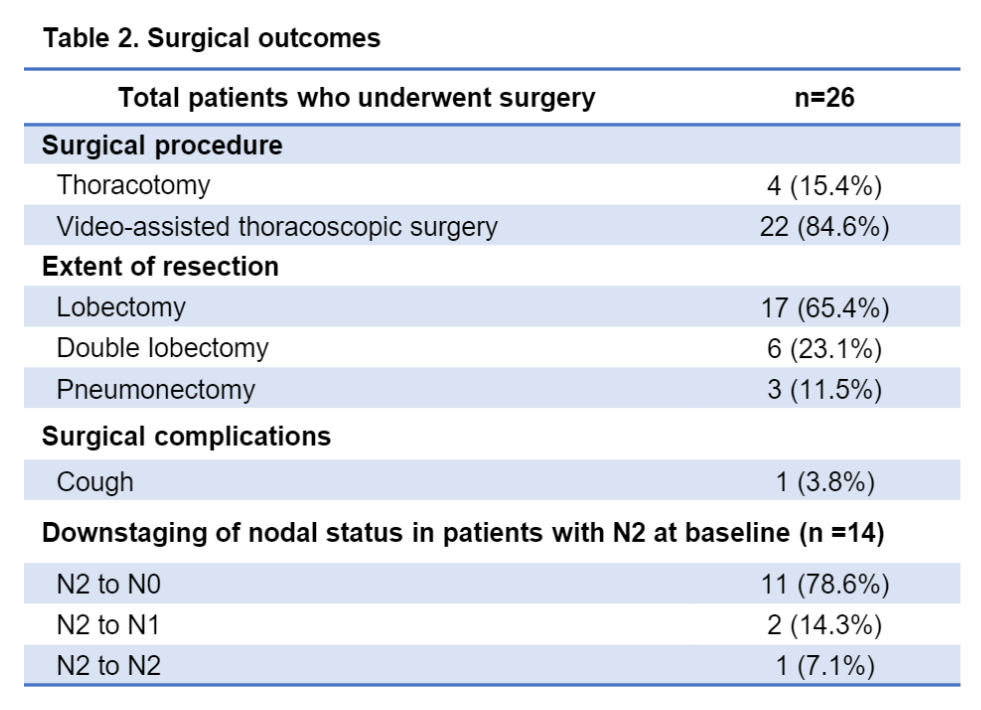
手术结果
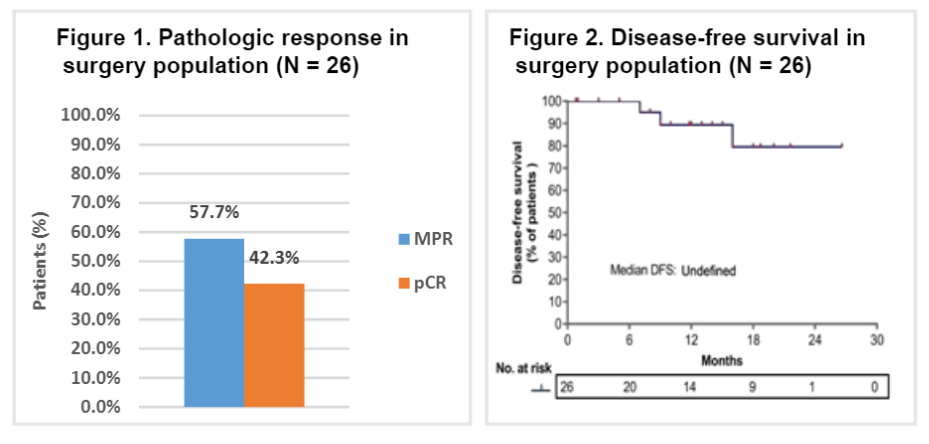
手术人群的pCR和DFS数据
更新结果进一步证明,特瑞普利单抗联合含铂双药化疗新辅助治疗潜在可切除NSCLC是高效且耐受性良好的。更重要的是,预期生存率有望提高。
Neoadjuvant Toripalimab combination in patients with stage IIB-IIIB NSCLC:a single-arm,phase 2 trial(Renaissance Study)
▌ 特瑞普利联合含铂双药化疗新辅助治疗IIB-IIIB期NSCLC:一项II期、单臂研究(Renaissance研究)
(摘要号:WS08.22)
PD-1抑制剂在NSCLC中已显示出潜在的抗肿瘤活性。本研究为单中心,前瞻性研究,旨在探索特瑞普利单抗联合含铂双药化疗新辅助治疗IIB-IIIB期NSCLC的疗效和安全性。
本研究纳入了IIB-IIIB期,EGFR/ALK野生型,ECOG PS 0-1的NSCLC患者。患者接受2-4个周期的特瑞普利单抗(240mg,q3w)联合含铂双药化疗的新辅助治疗,并于第2周期治疗后接受影像学/手术指征评估。不能进行手术的患者将在额外的1-2个周期新辅助治疗后重新评估。主要终点为MPR、pCR。次要终点为客观缓解率(ORR)、R0切除率和安全性。
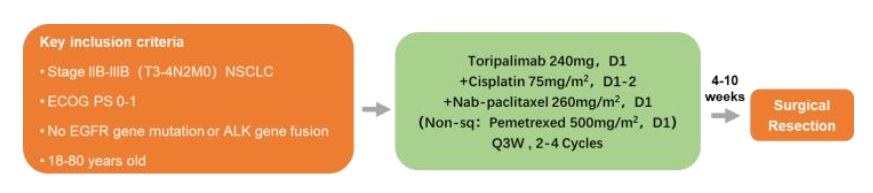
试验设计
自2021年3月,共53例患者(中位年龄:62岁,IQR:45-76;女性:5,9.4%;鳞状细胞癌:42,79.2%)被纳入研究,并接受了2-4个周期的新辅助治疗。其中IIB期、IIIA期和IIIB期患者分别为15、30和8例。15例处于术前阶段或不适合手术。
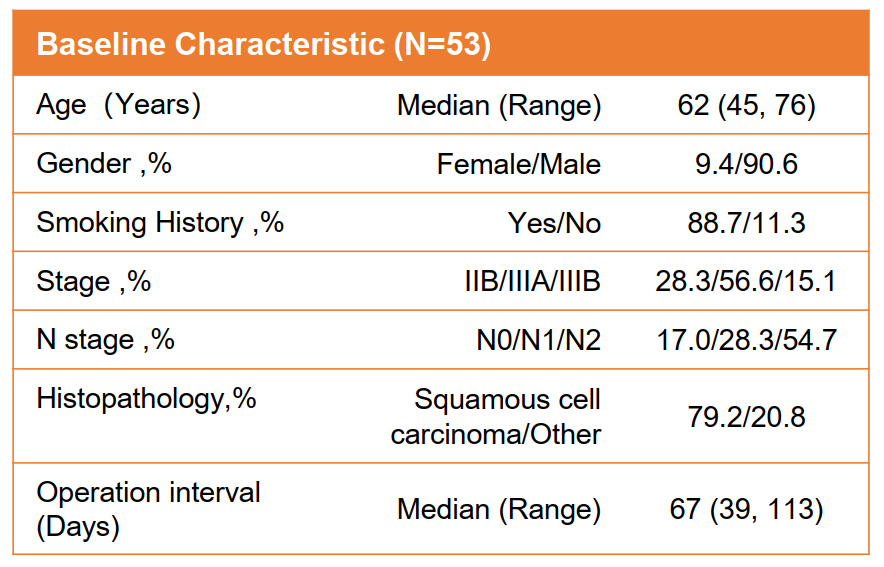
患者基线数据
39例患者接受了手术(新辅助治疗和手术间中位间隔:67天,IQR:39-113)。25例(25/39,64.1%)获得MPR,其中20例(20/39,51.3%)实现了pCR。所有39例(100%)均实现R0切除。29例(29/31,93.5%)患者在基线时接受了cN2/N1手术,实现了淋巴结减期。49名患者完成了治疗计划和影像学复查,ORR为85.7%(42/49)。

影像学缓解数据
分别有46例(46/49,93.9%)和15例(15/49,30.6%)患者报告了1-2级和3-4级TRAEs。在接受手术的患者中,3名患者(3/39,7.7%)经历了2-3级irAE(肠炎或皮疹)并接受了糖皮质激素治疗。有趣的是,这3名患者都实现了pCR,新辅助治疗与手术间中位间隔为56天(IQR:56-70)。与所有接受手术的患者相比,这3例患者没有治疗相关的手术延迟和额外的手术难度。这或预示经历2-3级irAE患者的pCR率更好(100%比47.2%)。
在准备手术或不适合手术的患者中,2例患者经历了2-3级irAE(肠炎或肺炎)并接受了糖皮质激素治疗,1例在新辅助治疗后出现部分缓解(PR),并在观察10个月后保持病情稳定(SD);另1例在接受新辅助治疗后临床完全缓解(cCR)。
在所有5名经历irAE并接受糖皮质激素治疗的患者中,irAE中位发病时间为12天(IQR:7-54),糖皮质激素疗法的中位持续时间为12天(IQR:7-79)。
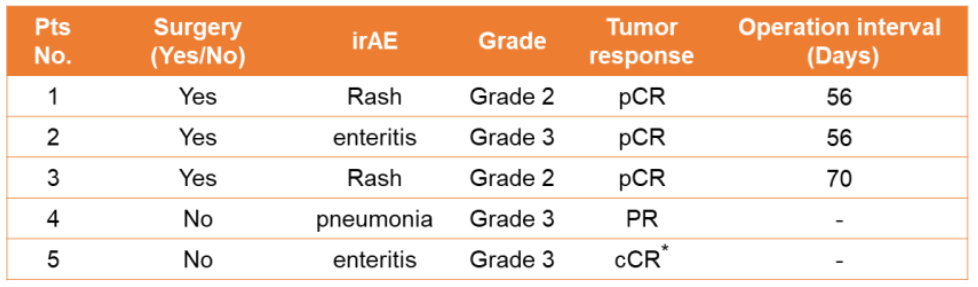
患者irAE数据
结果显示,特瑞普利联合含铂双药化疗新辅助治疗IIB-IIIB期NSCLC患者疗效显著、安全可耐受,具有应用前景。2-3级irAE与该方案疗效或存在潜在相关性。
Aumolertinib Versus Erlotinib/Chemotherapy for Neoadjuvant Treatment of Stage IIIA EGFR-mutant NSCLC(ANSWER)
▌ ANSWER研究:阿美替尼对比厄洛替尼/化疗用于IIIA期EGFR突变NSCLC新辅助治疗的研究
(摘要号:EP05.02-009)
对于IIIA-N2期EGFR突变的NSCLC,已有多项随机对照研究对各种EGFR-TKI靶向治疗联合化疗作为新辅助治疗进行了比较。然而,第三代EGFR-TKIs在新辅助环境中的作用仍未有定论。阿美替尼是一种新型的第三代EGFR TKI,在中国被批准用于治疗EGFR突变的NSCLC。ANSWER研究将评估阿美替尼与厄洛替尼/双联铂化疗(培美曲塞加卡铂或顺铂)新辅助治疗可切除的EGFR突变IIIA期NSCLC的疗效和安全性。
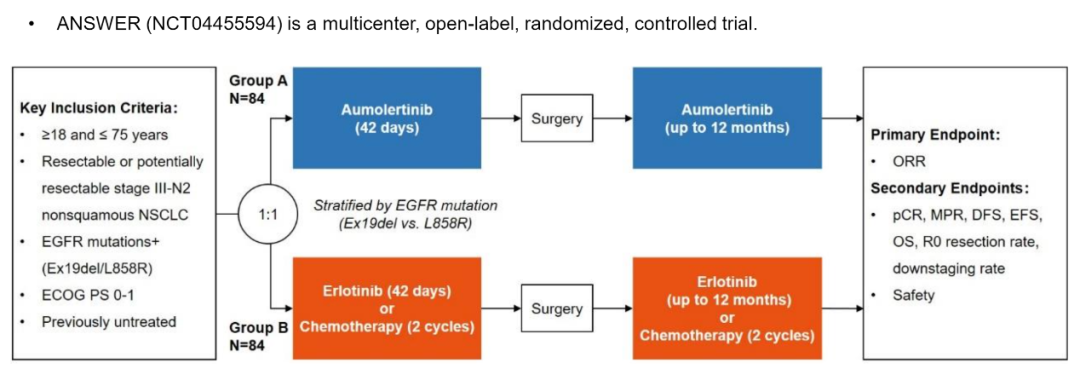
试验设计
这是一项多中心,开放标签,随机对照试验。既往未经治疗、组织学证实可切除或潜在可切除的IIIA-N2期非鳞NSCLC患者,且携带敏感EGFR突变,符合本研究条件。约168例患者将被随机(1:1)分为阿美替尼组(A组)或厄洛替尼/化疗组(B组),根据EGFR突变进行分层(Ex19del vs.L858R)。A组患者口服阿美替尼110 mg/d(新辅助治疗,42d;辅助治疗,最长12个月),B组患者口服厄洛替尼150 mg/d(新辅助治疗,42 d;辅助治疗,最长12个月)+培美曲塞500 mg/m2+卡铂AUC 5或顺铂75mg/m2(新辅助治疗,2个周期;辅助治疗2周期)。主要终点为ORR。次要终点包括pCR、MPR、DFS、无事件生存期(EFS)、OS、R0切除率、降期率和安全性。不良反应按CTCAE v.4.0分级。首名患者于2021年9月入组,预计完成时间为2025年Q4。期待中国团队的好消息!
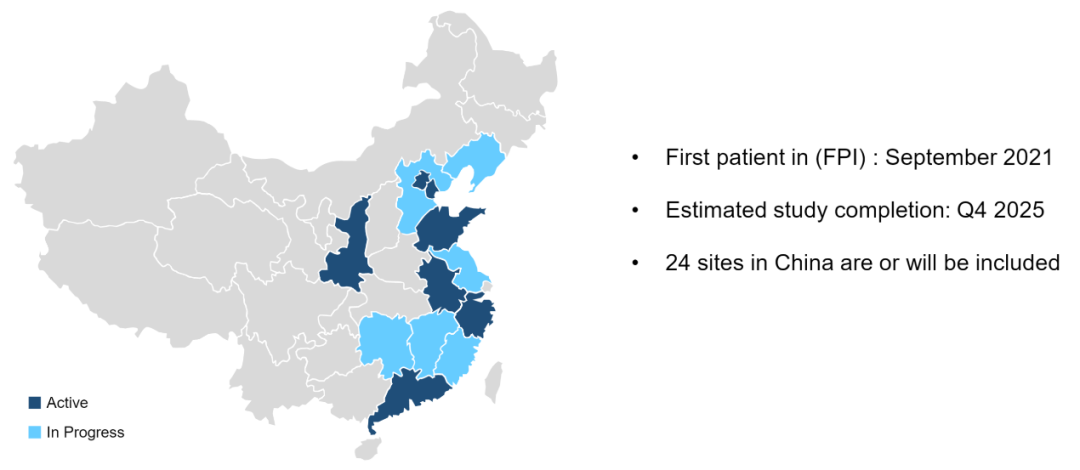
试验入组情况
Neoadjuvant DS-8201 for Stage III Non-small Cell Lung Cancer with HER2 20ins
▌ 新辅助DS-8201在HER2 20ins III期NSCLC患者中的疗效
(摘要号:EP05.02-006)
III-N2期NSCLC是一种高度异质性疾病,需要多模式治疗。当前期手术难以达到肿瘤缩小的目的时,则需要进行新辅助治疗。Trastuzumab deruxtecan(DS-8201)是一种新型抗体-药物偶联物(ADC),四种拓扑异构酶I抑制剂与HER2靶向抗体连接。既往研究表明,其在先前治疗的转移性HER2突变NSCLC中,ORR为55%,并具有持久的疗效。然而,DS-8201在早期和局部晚期NSCLC患者中的疗效和安全性尚未研究。
本研究报告了一例20ins IIIA3期NSCLC患者,接受了3个周期的新辅助DS-8201(345mg q3w)治疗,后行R0手术切除。治疗前后分别行PET-CT和脑MR检查。根据RECIST 1.1版,由2名独立医生评估放射反应,由2名独立的病理医生评估和回顾病理反应。记录副作用和手术结果。
患者,女性,58岁,从不吸烟,诊断为IIIA期(cT1cN2M0)肺腺癌。至我院时无肿瘤相关症状,(ECOG)PS为0。治疗前PET-CT显示左肺上叶有实性结节,同侧气管旁下、主动脉下、肺门淋巴结肿大,葡萄糖摄入增加。
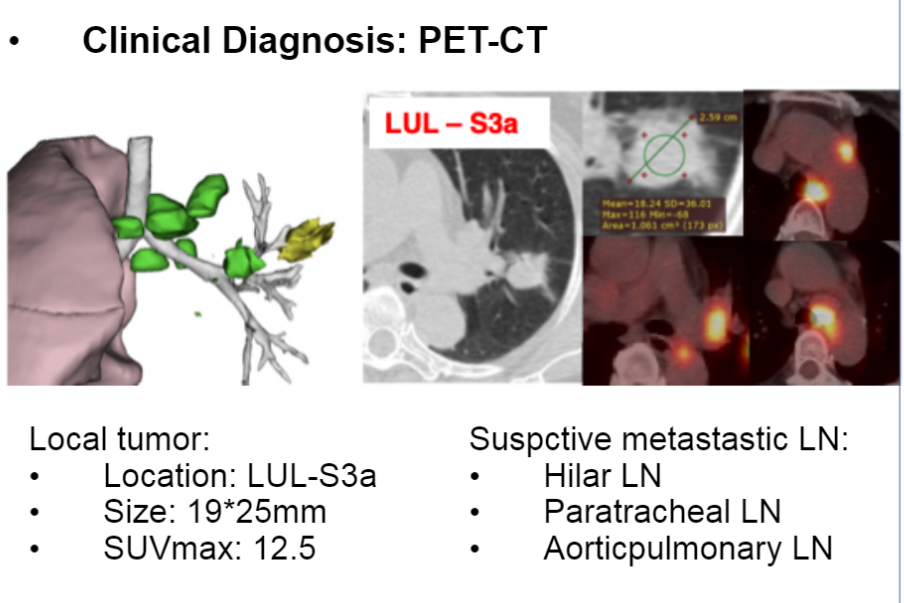
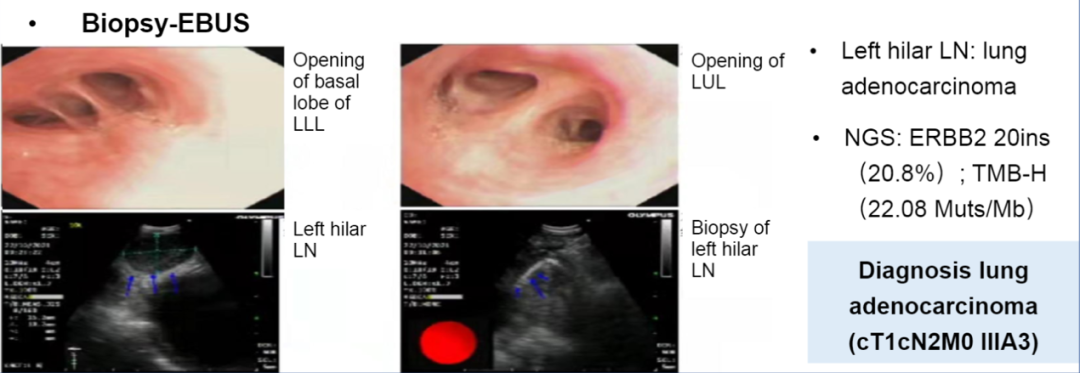
诊断信息
考虑到HER2突变NSCLC的潜在可切除性以及缺乏最佳治疗方案的现状,多学科委员会建议DS-8201治疗后进行局部干预。经过3个周期治疗后部分缓解。在原发性和转移性病变之间观察到缓解的异质性,原发性肿瘤缩小25%,而转移性淋巴结缩小65%。在最后一剂DS-8201后3周进行左上叶切除并进行全身淋巴结清扫,达到完全切除(R0)。手术持续了100分钟,术中失血20ml。术中未发现广泛的胸壁粘连、纤维化及新生血管形成。术后3天出院,无术后并发症发生。
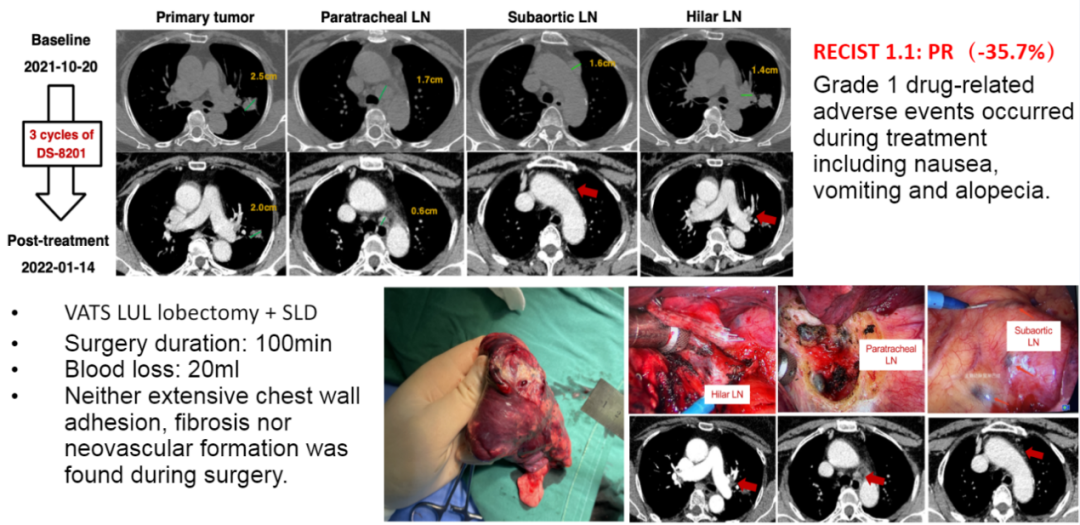
治疗过程
系统病理评估显示80%残存活肿瘤细胞。除下气管淋巴结外,被切除的淋巴结都没有癌细胞。治疗期间发生恶心、呕吐、脱发等1级药物相关不良事件。免疫组织化学(IHC)检测提示CD4(10%)、CD8(10%)、CD20(10%)、CD163(30%)、CD38(10%)细胞浸润。免疫组化后肿瘤细胞HER2蛋白表达低(IHC 1+),PD-L1表达阴性(22C3)(TPS<1%)。外周血分析表明,治疗诱导T细胞库多样化。
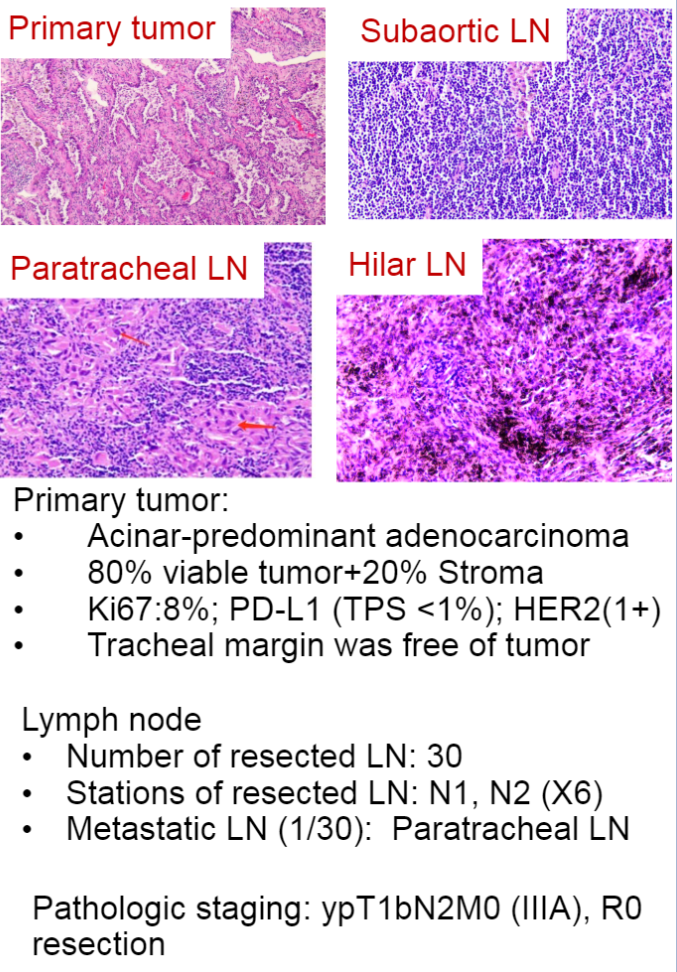
病理结果详情
DS-8201已被证明在局部晚期NSCLC中具有抗癌活性,副作用小且不延误手术。无论HER-2蛋白表达如何,DS-8201均可发挥作用。本病例对ADC在新辅助治疗中的潜在应用提供了一个深入了解。
专家点评
新辅助免疫治疗是今年WCLC的焦点版块,会议报道了多项重磅临床研究和标志物研究的结果,引发了极大的关注和热烈的讨论。其中,NADIM ll研究的最新生存数据证实了新辅助化免联合的高效性及良好安全性,而特瑞普利单抗通过相似的严谨设计,在今年的数据随访更新中,也报道了很好的疗效和安全性,这使得化免联合模式在肺癌新辅助治疗中的应用前景被进一步看好。而在相关的标志物研究中,发现肿瘤部分基因的RNA异常表达与疗效不佳相关,而免疫相关不良反应而可能是化免联合治疗获益的预测因素,这可能为将来优化新辅助联合治疗提供参考。
此外,针对驱动基因阳性患者的新辅助治疗也受到关注,今年的会议报道了一项在EGFR突变患者中采用化疗联合靶向治疗的头对头研究(阿美替尼vs厄洛替尼)设计,以及一项针对HER-2突变肺癌患者采用DS-8201新辅助治疗的病例报道,虽然这些治疗方案尚缺乏有力的研究数据支撑,但有理由相信这类治疗模式有望进一步优化肺癌的多学科管理,进一步改善患者的预后。
专家简介

胡志皇
医学博士、副主任医师,复旦大学附属肿瘤医院
胸部肿瘤内科科主任助理
美国临床肿瘤学会(ASCO)会员
中国抗癌协会临床肿瘤化疗专委会委员
中国医药教育协会肺部肿瘤专委会COE秘书
中国临床肿瘤学会(CSCO)会员
上海市抗癌协会会员
上海市抗癌协会CRPC青委会常委
从事肺癌、食管癌等胸部肿瘤的内科治疗与研究,在肿瘤新靶点鉴定、分子标志物研究、肿瘤姑息治疗等领域有较深入研究,曾发表SCI论文十余篇,主持科研基金2项。
本文首发:医学界肿瘤频道
本文作者:Lily
责任编辑:Sweet
| 留言与评论(共有 0 条评论) “” |