*仅供医学专业人士阅读参考

2022 ESMO前沿进展
激素受体阳性(HR+)乳腺癌(BC)约占全部乳腺癌的70%,贯穿HR+BC整个治疗周期的内分泌治疗,在降低肿瘤复发风险上可谓“居功至伟”。但内分泌治疗无论药物的选择,还是治疗周期的把握,在越来越强调疾病全程精准管理的今天,无疑成为乳腺癌临床医生关注的焦点。
2022年欧洲肿瘤内科学会(ESMO大会)已于9月9日~9月13日在巴黎顺利召开,大会上报告了多项关于乳腺癌的重磅前沿成果。其中关于内分泌治疗的这3项重要研究,不容错过~
三阳BC后线去化疗方案新探索!
传统分型“剧透”治疗效果!
▌ monarcHER II期:阿贝西利+曲妥珠单抗±氟维司群vs曲妥珠单抗+化疗治疗HR+/HER2+ABC的最终总生存期(OS)
摘要号:LBA18
monarcHER是一项随机、多中心、开放标签的II期试验,旨在比较口服选择性CDK4/6抑制剂阿贝西利+曲妥珠单抗±氟维司群与曲妥珠单抗+标准化疗加在HR+/HER2+ABC中的疗效。本次大会公布了最终OS结果,以及通过RNAs测序数据评估内在亚型的探索性生物标志物分析数据。
本研究共入组既往至少接受2种抗HER2治疗、未接受过CDK4/6抑制剂和氟维司群治疗的激素受体阳性HER2阳性晚期乳腺癌患者237例,并以1:1:1随机分至A组(阿贝西利+曲妥珠单抗+氟维司群)、B组(阿贝西利+曲妥珠单抗)和C组(曲妥珠单抗+化疗)。主要研究终点为无进展生存(PFS),次要研究终点为客观缓解率(ORR)、安全性、OS、患者报告结局和药物代谢动力学等。分层因素包括基线病灶是否可测量和既往全身治疗线数。同时,通过RNA测序数据分析乳腺癌不同内在亚型进行探索性生物标志物分析。
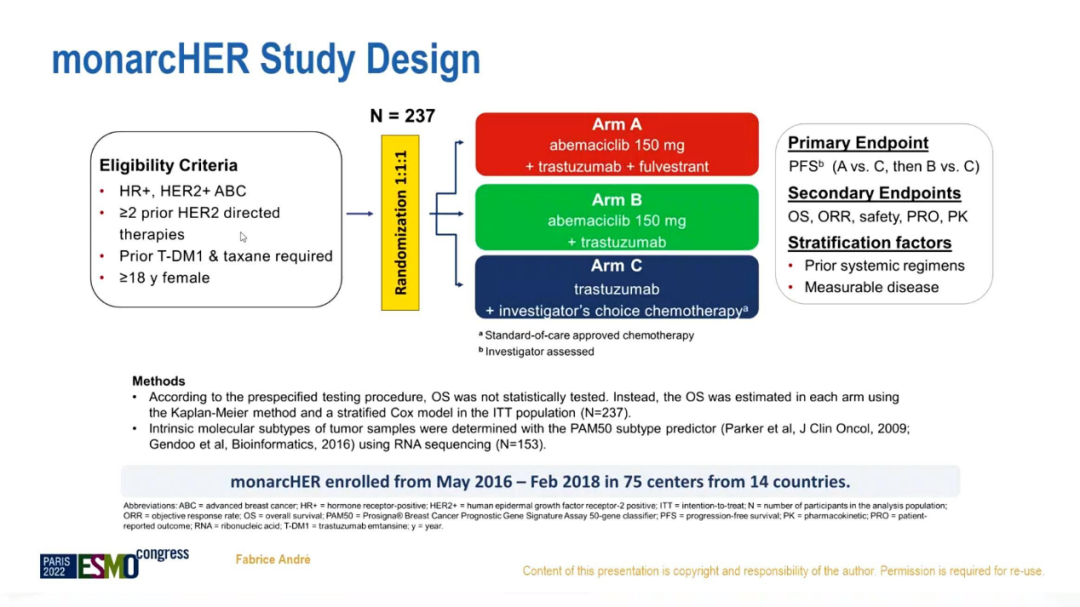
研究流程
结果显示,共发生157例死亡:A组50例(63%),B组54例(68%),C组53例(67%)。经过52.9个月的中位随访时间,三组的mOS分别为30.3、29.2和20.7个月(A vs C:HR=0.71;95%CI 0.48-1.05;双侧p=0.086;B vs C:HR=0.84;95%CI 0.57-1.23;双侧p=0.365)。
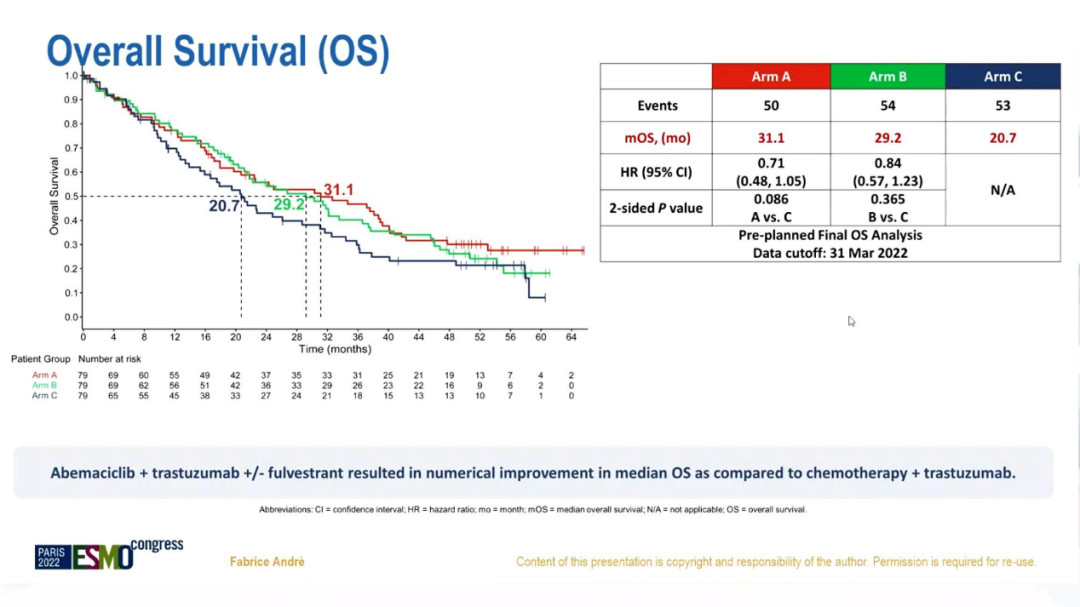
OS分析
OS的亚组分析显示,与化疗+曲妥珠单抗相比,阿贝西利+氟维司群+曲妥珠单抗在各预设亚组获益一致。
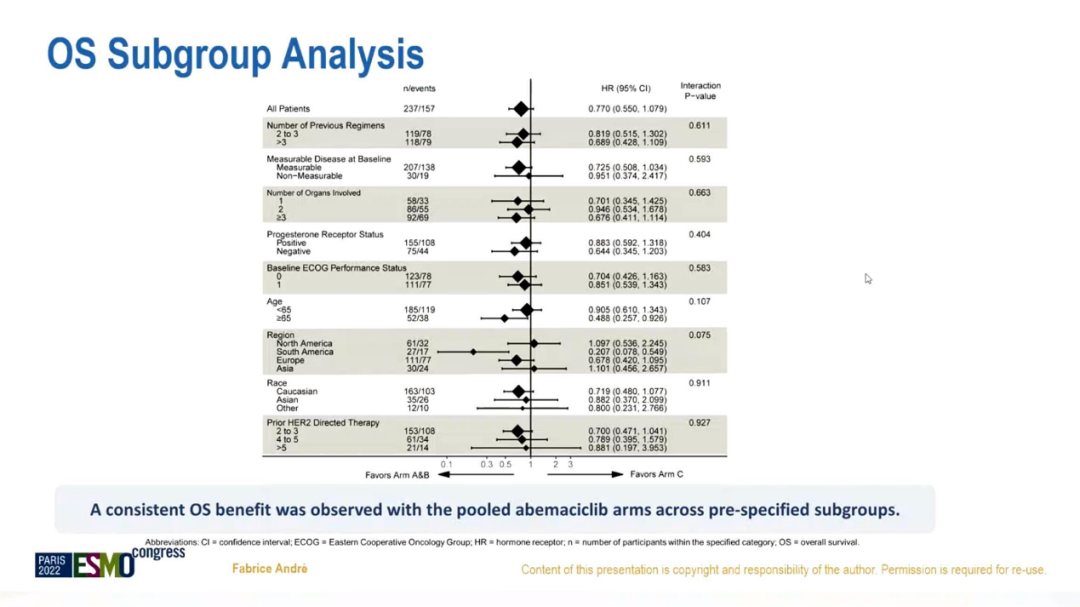
OS亚组分析
在探索性RNA测序数据分析中,与非luminal亚型相比,luminal亚型PFS(8.6 vs 5.4个月;HR=0.54;95%CI 0.38-0.79)和OS(31.7 vs 19.7个月;HR=0.68;95%CI 0.46-1)均较长。
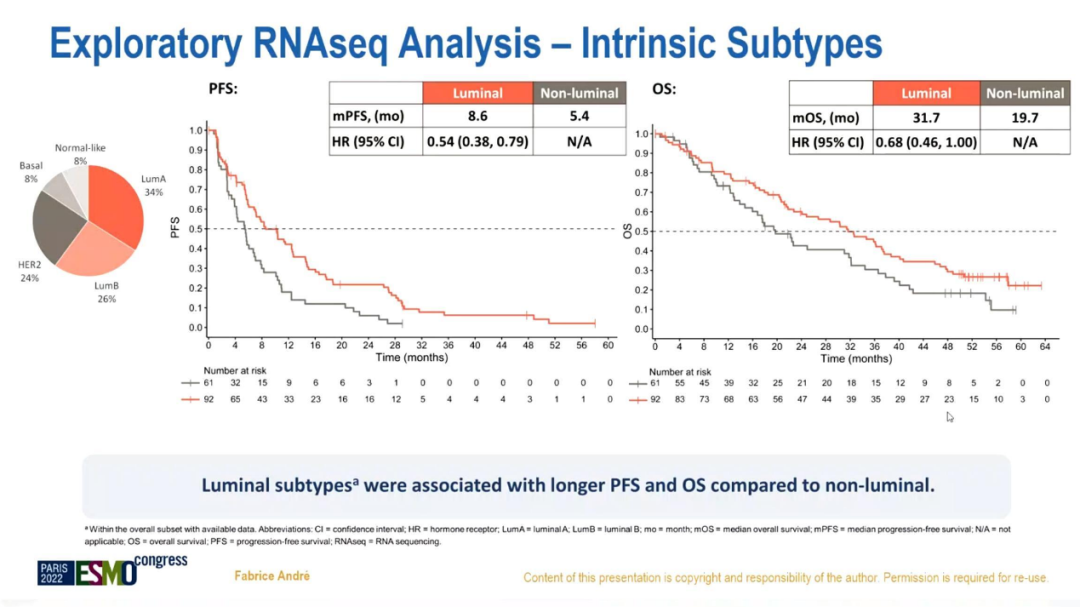
探索性RNA测序数据分析
在安全性上,未观察到新的安全性信号,与初步分析一致。
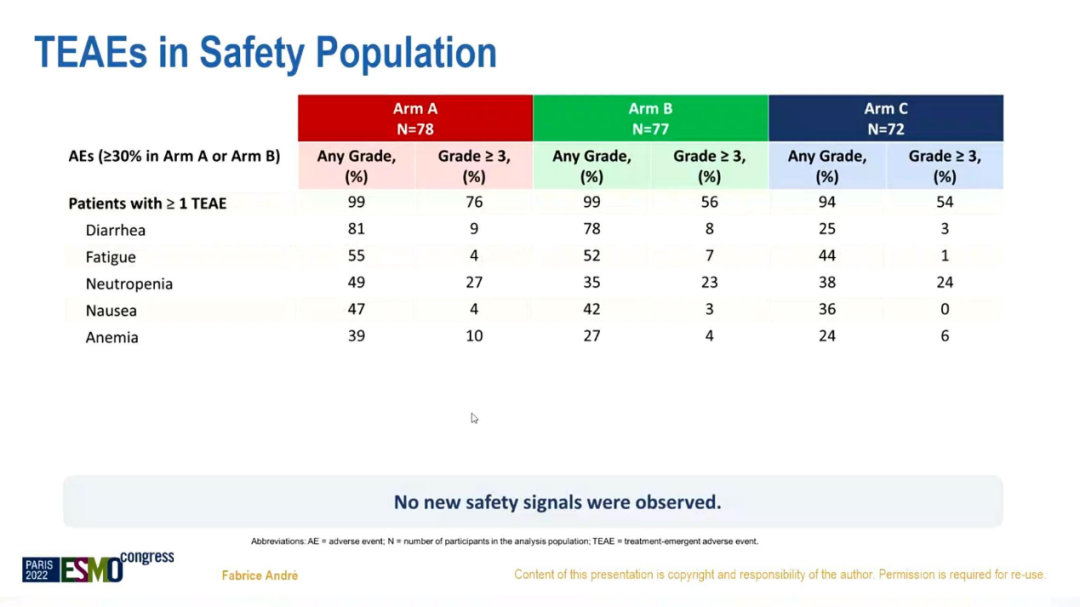
安全人群的不良反应数据
综上,与化疗+曲妥珠单抗相比,阿贝西利+曲妥珠单抗±氟维司群在数值上改善了HR+/HER2+ABC患者的OS,绝对获益达8.5-10.4个月,总死亡风险减少约16%-29%;安全性可控,与既往研究一致;与非luminal亚型相比,luminal亚型的PFS和OS均显著延长。
早期耐药或可预测?
新标志物“指路”治疗方案!
▌ 突变特征分析揭示了ER+/HER2-MBC中与ET+/-CDK4/6i耐药相关的基因组不稳定性特征
摘要号:210O
APOBEC突变在MBC中富集。然而在MBC患者中,APOBEC和其他突变过程对标准治疗方案的预测作用尚未厘清。本研究旨在探索ER+/HER2-MBC中与内分泌治疗(ET)+/-CDK4/6抑制剂(CDK4/6i)耐药相关的基因突变特征。
研究者检索了4595例乳腺癌的临床和基因组数据,通过FDA认证的包含超过400个基因的Panel进行靶向测序。根据SigMA定义的显性突变过程,乳腺癌被分为APOBEC+、HRD+或APOBEC-/HRD-分型。使用单变量和多变量Cox模型评估任何治疗线数(L)的PFS。
研究流程
结果显示,APOBEC+和HRD+在MBC中的比例均高于原发肿瘤(24%和24%vs 15%和13%;p<0.001)。APOBEC+在ER+/HER2-(19%)和HER2+亚型(47%)中高表达,而HRD+则在三阴性亚型(36%)中高表达。
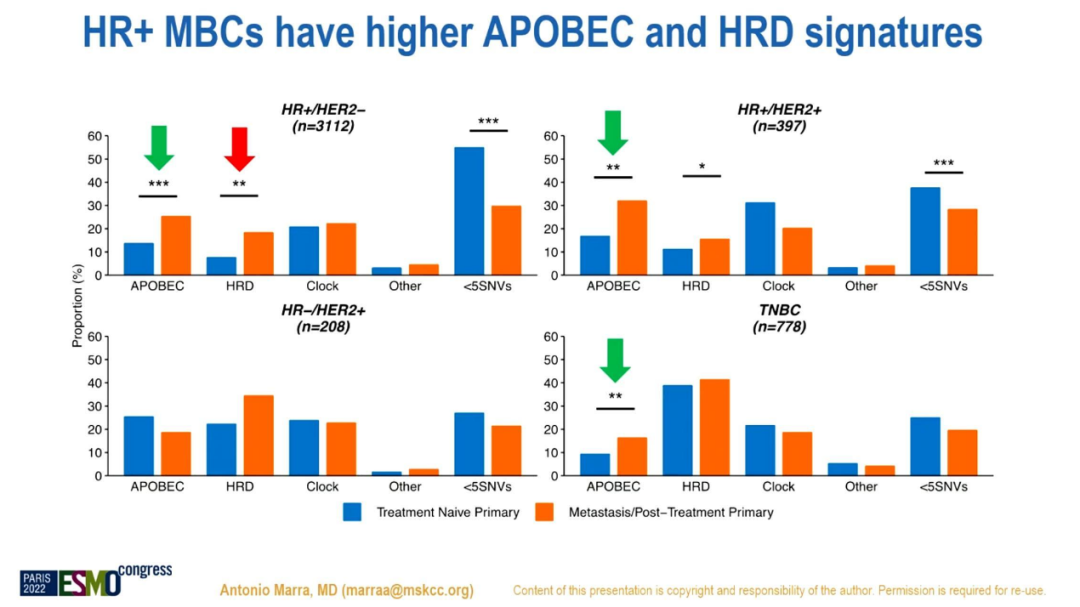
HR+MBC的APOBEC和HRD突变特征
小叶浸润性BC中APOBEC+的比例高于HRD+和APOBEC-/HRD-的比例(34%vs 10%vs 21%,p<0.001)。有APOBEC突变的ER+/HER2-MBC显示较低的ESR1突变(p<0.001)。
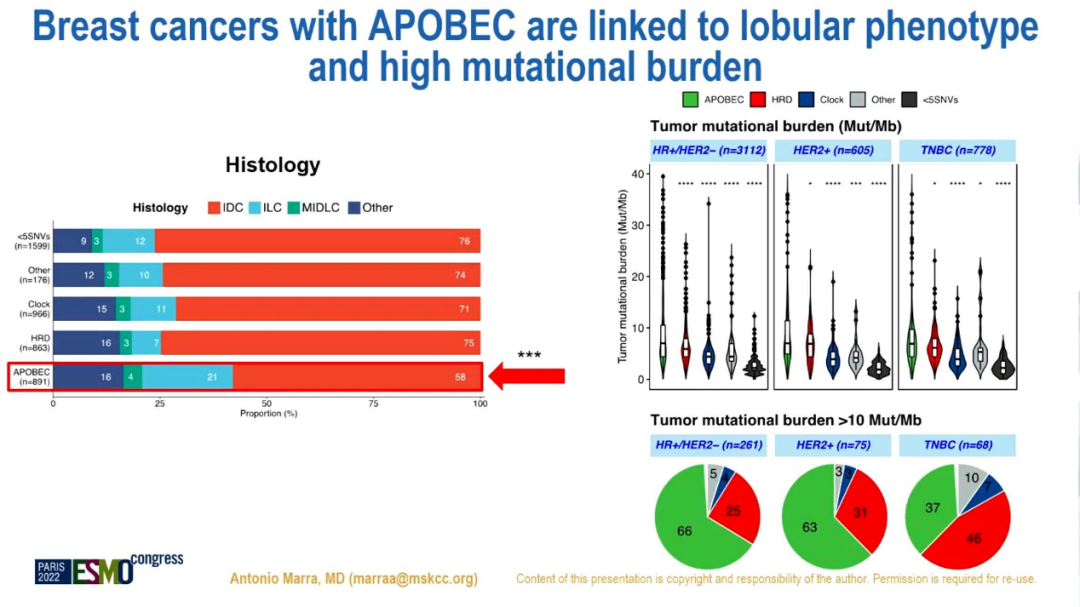
APOBEC突变与小叶浸润性BC及高突变负荷相关
有治疗前样本患者的生存分析显示,在接受1L或2L ET单药治疗的ER+/HER2-MBC(n=395)中,无论ET药物种类,APOBEC+肿瘤都与更短的mPFS独立相关(HR 1.6,95%CI 1.2-2.2,p=0.001)。在1L接受CDK4/6i+ET治疗的MBC(n=419)中,与APOBEC-/HRD-相比,APOBEC+和HRD+的mPFS更低(HR 1.5,95%CI 1.1-2,p=0.01和HR 1.7,95%CI 1.2-2.5,p=0.006),且与联合的ET药物种类无关。HRD+BC在2L(n=207)和3L(n=372)接受CDK4/6i+ET治疗的mPFS均降低(HR 2.1,95%CI 1-4.1,p=0.03,HR 1.8,95%CI 1.3-2.5,p=0.001)。
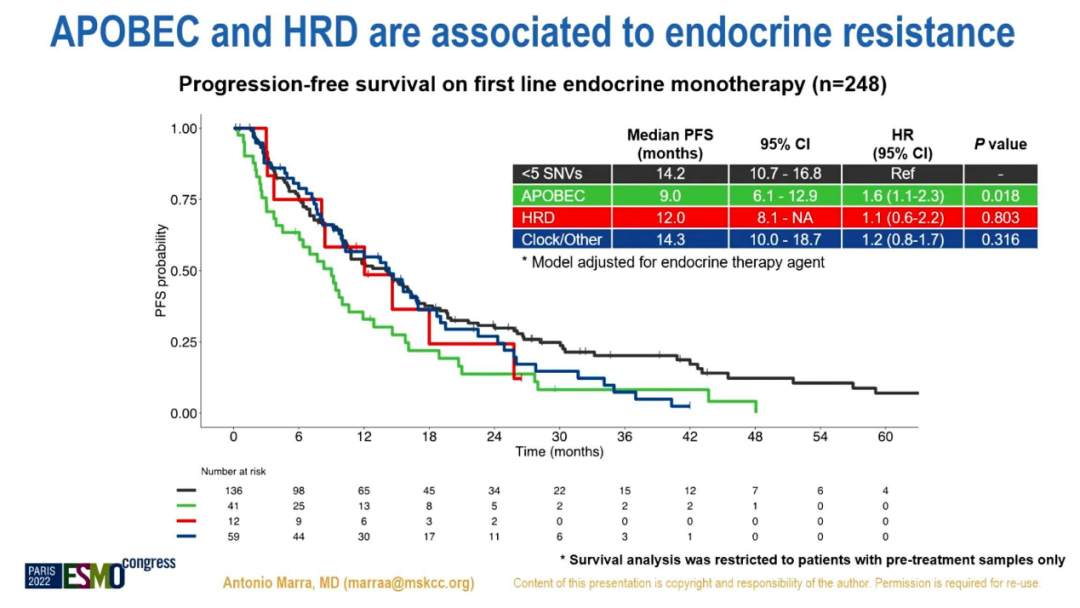
突变特征对一线ET单药治疗PFS的影响
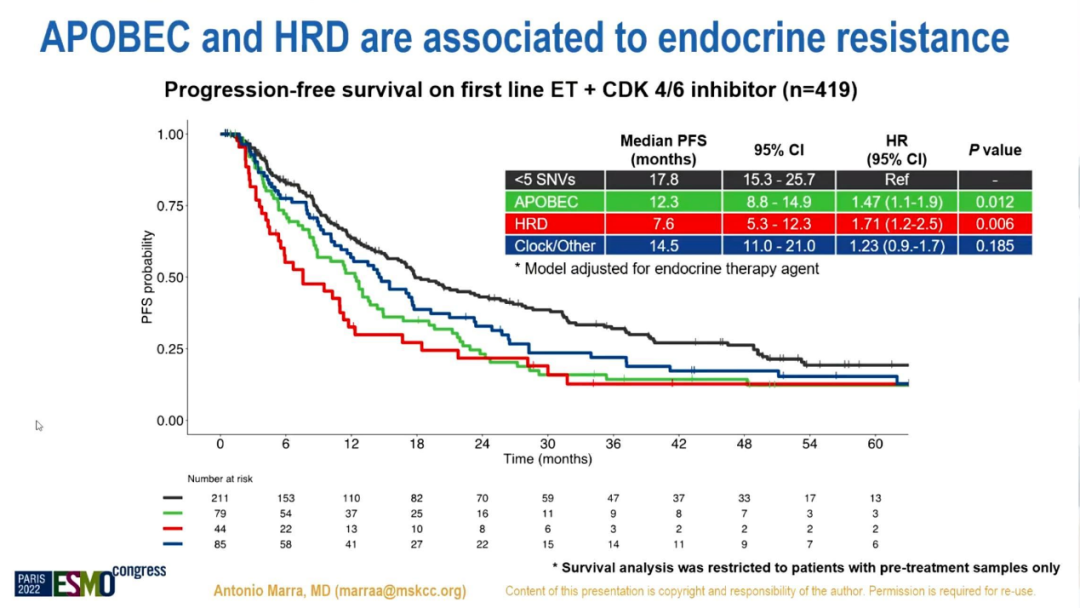
突变特征对一线ET+CDK4/6i治疗PFS的影响
综上,APOBEC+和HRD+的ER+/HER2-MBC患者,接受ET+/-CDK4/6i治疗方案的生存期较短,提示APOBEC和HRD带来的基因组不稳定性可导致早期耐药,需要针对这些BC亚组量身定制新型疗法。目前更多的基因组分析正在推进,以揭示与APOBEC和HRD相关的突变模式。
延长内分泌治疗策略有必要吗?
这些特征或可“筛选”获益人群!
▌ 序贯内分泌治疗后延长芳香化酶抑制辅助治疗:III期DATA试验的最终结果
摘要号:133O
目前,对于绝经后HR+乳腺癌,ASCO和ESMO指南推荐使用5年AI,他莫昔芬序贯AI共5年,或5年他莫昔芬序贯5年AI。然而,序贯使用AI时间超过5年是否带来临床获益尚未有证据。DATA研究是一项III期、开放标签、随机对照试验,旨在评估激素受体阳性早期乳腺癌患者使用他莫昔芬辅助治疗2-3年后,在无复发转移的情况下继续使用不同时间的阿那曲唑治疗的获益情况。本次大会公布了最终分析结果。
研究期间,共1912名在2-3年他莫昔芬辅助治疗后无复发或转移的HR+的绝经后乳腺癌患者,将以1:1的比例随机分配至3或6年阿那曲唑治疗组。按淋巴结状态、激素受体状态、HER2状态和既往他莫西芬治疗持续时间进行分层。主要终点是校正后无病生存(aDFS),定义为随机化3年后的DFS。次要终点为校正后总生存期(aOS)。
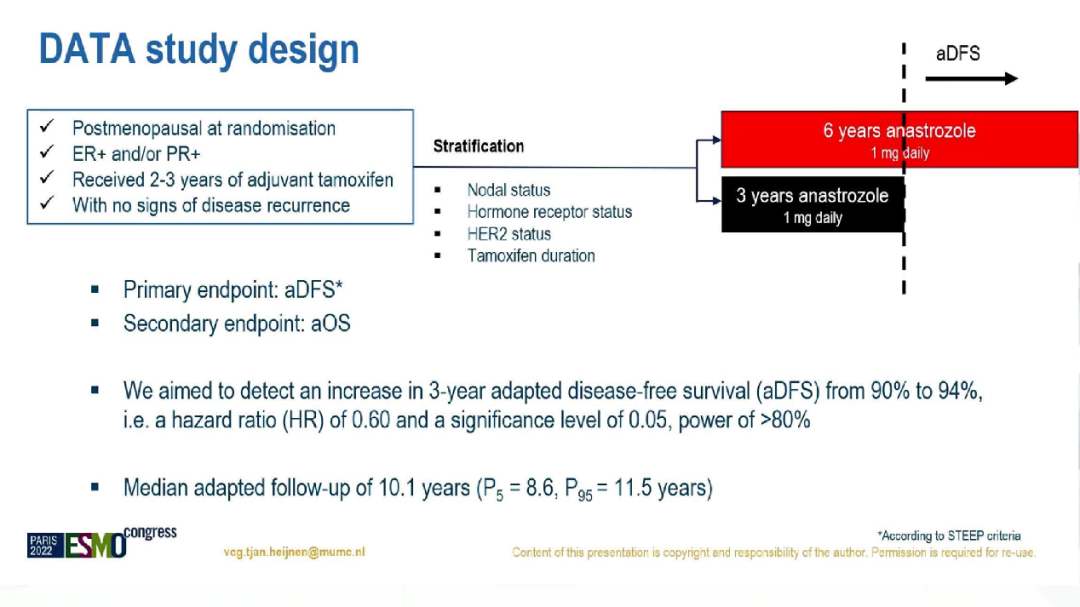
研究流程
最终,共1660名患者在随机分组后3年符合条件且无复发转移。其中淋巴结阳性患者占2/3,ER与PR双阳性患者占3/4。
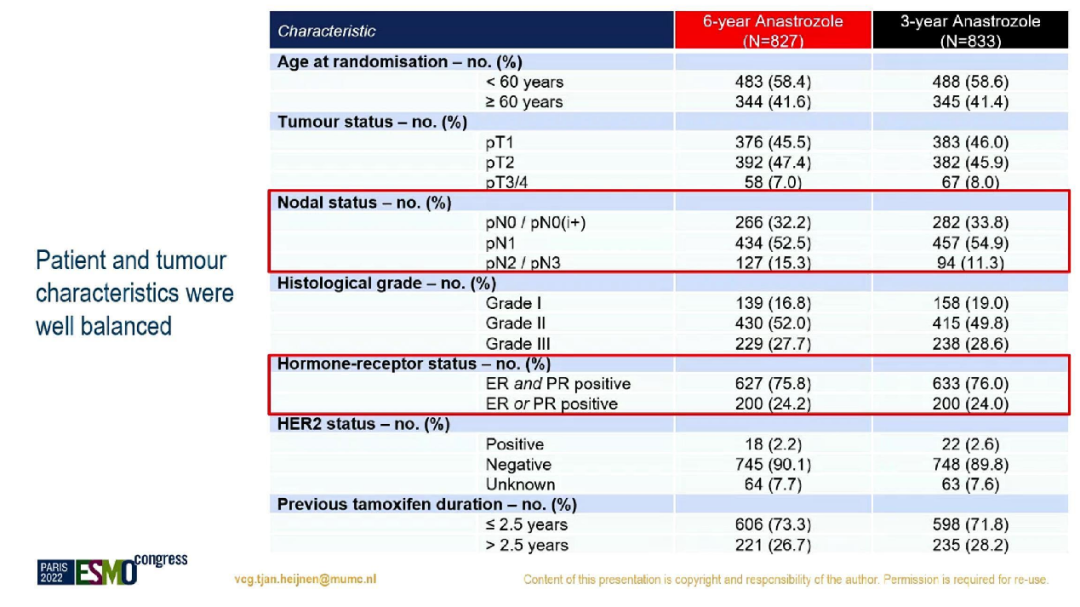
患者及肿瘤特征
经过中位校正后为10.1年的随访,6年组和3年组的10年aDFS分别为69.1%和66.0%(HR=0.86;95%CI:0.72-1.01;p=0.073),10年aOS则无显著差异,分别为80.9%比79.2%(HR=0.93;95%CI:0.75-1.16;p=0.53)。
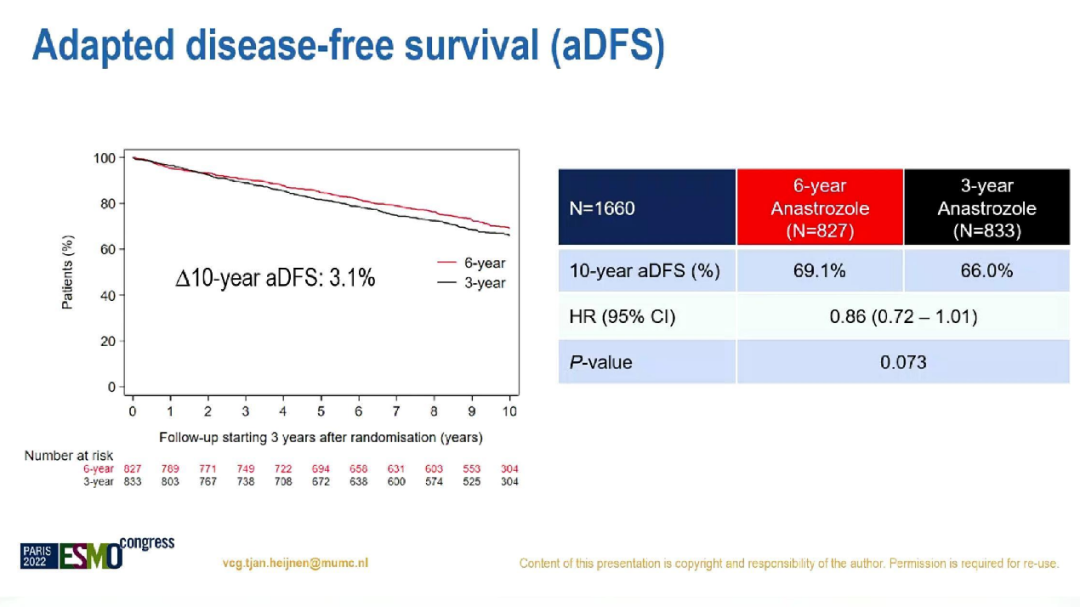
两组的10年aDFS
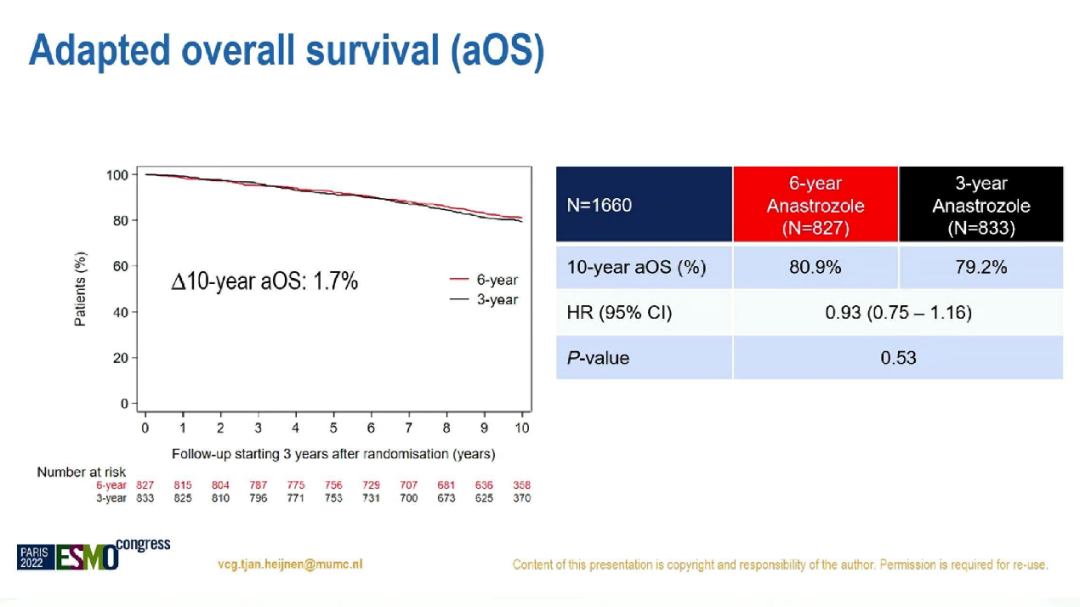
两组的10年aOS
分层分析显示,在ER和PR双阳性的肿瘤患者中,6年组的10年aDFS显著高于3年组(HR=0.77;95%CI:0.63-0.94;p=0.008);但激素受体单阳性的肿瘤患者中,两组的10年aDFS无差异(HR=1.22;95%CI:0.86-1.73;p=0.28)。激素受体双阳性与单阳性人群相比,延长治疗的10年aDFS获益显著(相互作用p=0.018)。
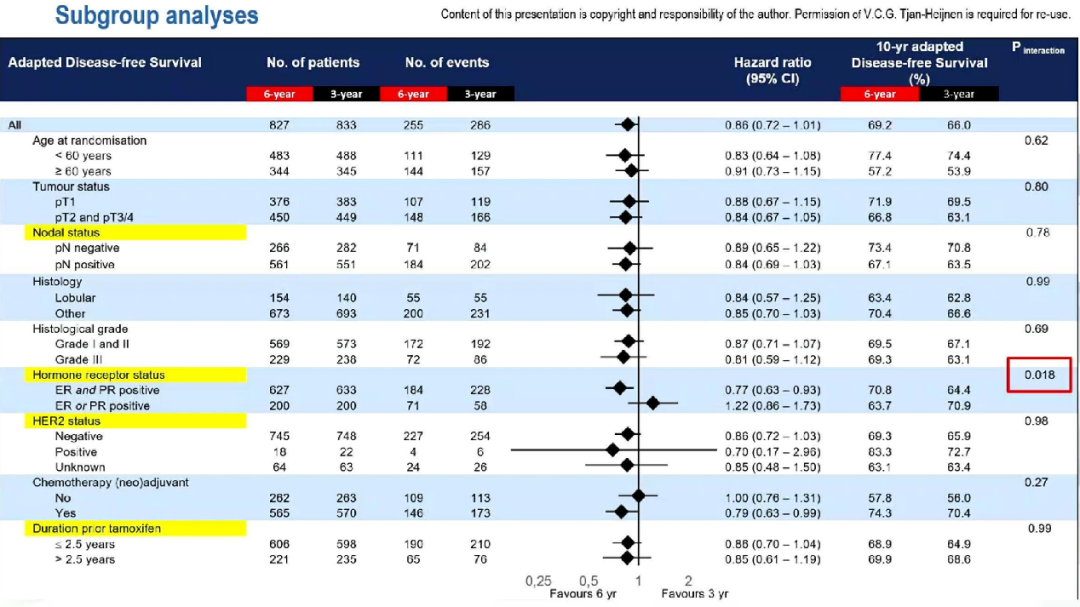
aDFS的亚组分析数据
此外,在淋巴结阳性、激素受体双阳性(n=849)患者中,6年组和3年组的10年aDFS分别为68.7%和60.7%(HR=0.74;95%CI:0.59-0.93;p=0.011),aOS则无显著差异(HR=0.84,95%CI:0.62-1.12;p=0.23)。
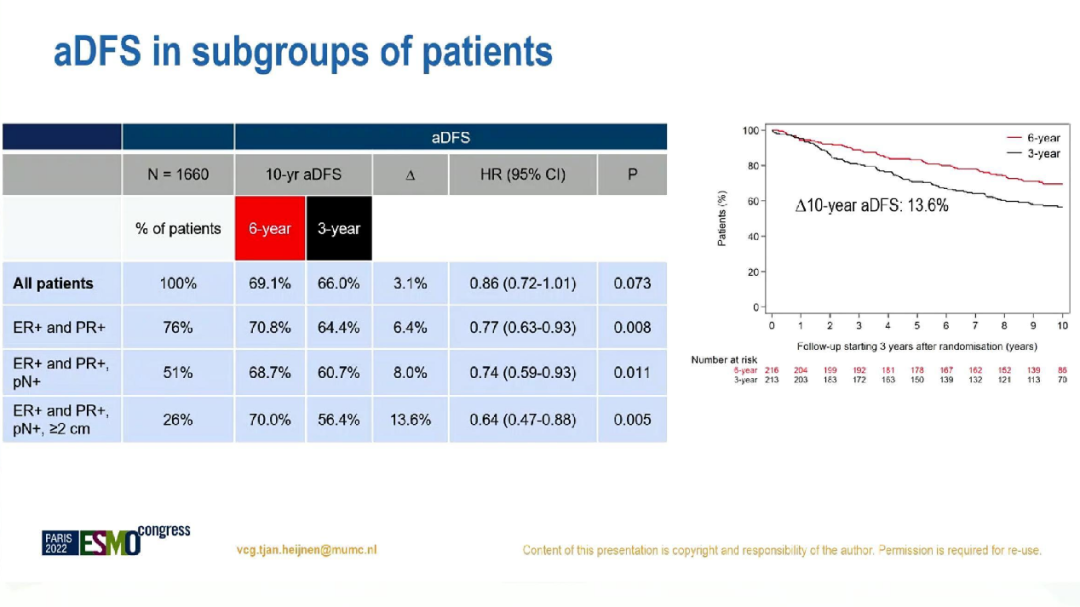
aDFS的亚组分析
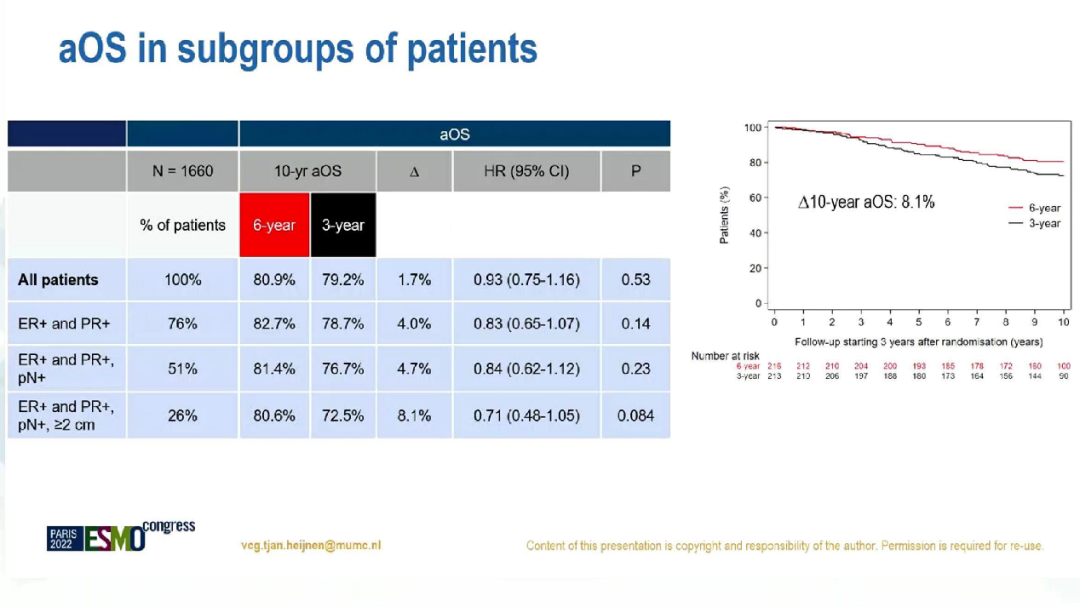
aOS的亚组分析
综上,并不建议在所有HR+的绝经后乳腺癌患者中延长芳香化酶抑制的序贯治疗超过5年。然而,淋巴结阳性、ER和PR双阳性的肿瘤患者或可从延长治疗获益。
随着内分泌治疗药物的和方案不断更新迭代,中国乳腺癌患者的5年生存率从2003-2005年期间的73.1%稳步上升至2012-2015年的82.0%,美国乳腺癌患者的5年生存率也已达90%。然而,研究者们攻陷HR+乳腺癌的步伐从未停止:例如药物研发上从经典的选择性ER调节剂他莫昔芬,芳香化酶抑制剂来曲唑、阿那曲唑,到新型的选择性ER受体下调剂氟维司群、艾拉司群等;上文三大研究覆盖了早期乳腺癌的延长治疗、晚期乳腺癌一二线及耐药后线治疗的方案选择和人群筛选等。
目前,乳腺癌内分泌治疗领域仍有多项研究正在推进,期待它们在未来能为乳腺癌患者带来治疗效果更强,生活质量更好,设计更为精准的内分泌治疗药物和方案~
本文首发:医学界肿瘤频道
本文作者:Lily
责任编辑:Sweet
| 留言与评论(共有 0 条评论) “” |