
撰文丨莜
#肿瘤#
KARS是肿瘤中常出现突变基因之一。因缺乏结合高亲和力小分子的“口袋”,KRAS蛋白曾是著名的“不可成药”靶点【1, 2】。KRASG12D是最常见的KARS突变,在胰腺癌、结直肠癌、肺腺癌、胆管癌等多种癌种中均有不同程度的表达【3】。研究发现G12C突变的变构开关-II口袋(S-IIP),可以被共价抑制,这也同时为KARSG12D抑制剂的研发提供了基础和方向。来自Mirati Therapeutic公司的研究人员发现了一个全新的选择性的非共价高亲和力的KARSG12D抑制剂MRTX1133,其能同时与处于失活状态和激活状态的KRASG12D突变体结合,其临床前数据以 Anti-tumor efficacy of a potent and selective non-covalent KRASG12D inhibitor 为题近日在线发表在Nature Medicine杂志上。


研究人员使用基于结构的药物设计策略合成了高亲和力和选择性KRASG12D抑制剂MRTX1133 。研究发现MRTX1133对 GDP结合KRASG12D的选择性约为KARS野生型的约700倍,同时与KRASG12D的非激活形式结合 IC50 < 2 nM,抑制激活型的KRASG12D与RAF-RAS蛋白的结合域RBD结合IC50为9 nM 。在多种主要的KARS G12D突变癌细胞系中都能选择性地抑制KARS依赖的信号通路。
在证明MRTX1133的选择性和高亲和力的抑制作用后,研究者又在KRASG12D突变的人胰腺癌异体移植的小鼠模型上验证了MRTX1133的作用。研究者分别给小鼠注射3mg/kg, 10mg/kg和30mg/kg的MRTX1133,注射后1小时和6小时明显观察对肿瘤细胞ERK磷酸化和pS6表达的抑制,同时RAS的激活水平也被抑制。在多次注射的试验中,MRTX1133表现出了剂量依赖的抗肿瘤效果。
为了证明MRTX1133抗肿瘤活性的广度,研究者选择了25种KRASG12D突变的模型,发现30mg/kg 每日两次的给药能够在其中11种突变类型的模型达到大于30%的肿瘤抑制效果(图1)。
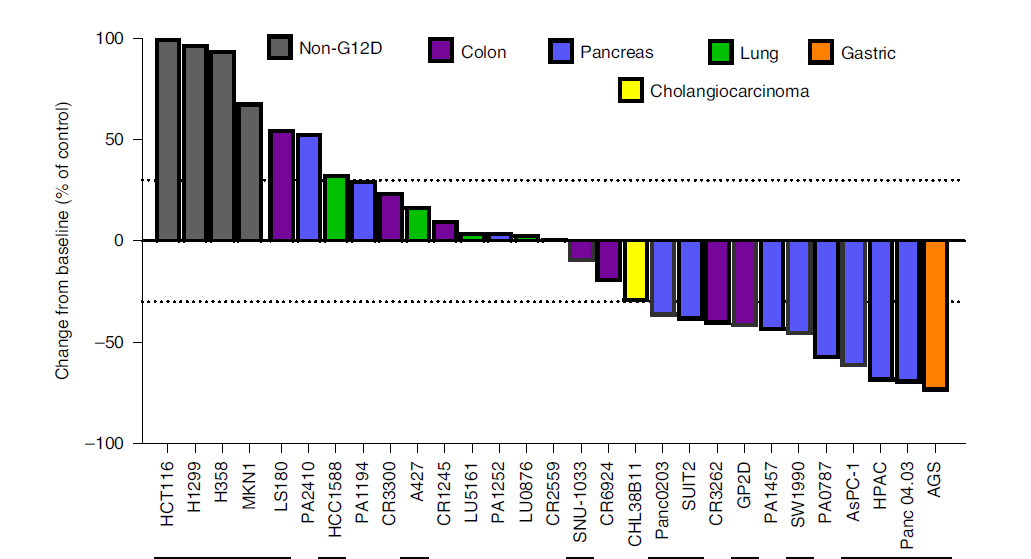
图1 人肿瘤细胞异体移植模型中MRTX1133的抗肿瘤活性
解析MRTX-1133引起的短暂分子变化能够为进一步阐明其抗肿瘤的作用机制提供依据。因此研究人员使用RNA-seq检测了各种突变类型的胰腺癌移植动物模型和细胞系中给药不同时间点后总基因表达的变化。GSEA信号通路富集分析发现KARS信号UP,KARS信号DOWN,MYC靶点,MTORC1,E2F靶点和G2M检查位点信号通路等都在给药后发生了显著差异,这些结果表明MRTX-1133能够协同影响KARS和肿瘤凋亡信号通路,达到抗肿瘤的效果。
EGFR信号通路与胰腺癌和结直肠癌的发生有着密切的相关性,因此研究人员探究了MRTX1133和EGFR单抗Cetuximab联合疗法对多种肿瘤细胞系移植模型的抗肿瘤效果。研究发现MRTX1133联用相比于单药能够显著抑制肿瘤细胞pERK和pS6的表达,显著提高抗肿瘤效应。
KRASG12D抑制剂因其缺乏结合位点一直难以开发共价小分子抑制剂,随着对其结构的进一步解析,科学家发现能够通过氢键结合和离子对相互作用结合KARS的S-II口袋,MRTX-1133应势而出。Mirati Therapeutic的这些临床前试验的研究为后期开发KRAS突变的肿瘤小分子药物的单药和联合治疗策略提供了很好的提示作用。
原文链接:
https://doi.org/10.1038/s41591-022-02007-7
参考文献
1. Sanchez-Vega, F. et al. Oncogenic signaling pathways in the cancer genome atlas. Cell 173, 321–337 (2018).
2. Simanshu, D. K., Nissley, D. V. & McCormick, F. RAS proteins and their regulators in human disease. Cell170, 17–33 (2017).
3. Li, S., Balmain, A. & Counter, C. M. A model for RAS mutation patterns in cancers: finding the sweet spot. Nat. Rev. Cancer 18,767–777 (2018).


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |