*仅供医学专业人士阅读参考
诸如AKT抑制剂、口服SERD、新型ADC药物等或将全面覆盖HR+/HER2-晚期乳腺癌治疗获益人群。
一年一度的圣安东尼奥乳腺癌大会(SABCS)已经于12月10日圆满落幕,作为乳腺癌领域最权威、最重要的国际盛会,2022年SABCS大会汇聚了一系列令人振奋的重磅临床研究成果。HR+/HER2-是乳腺癌的最常见亚型,约占总体乳腺癌的70%[1],随着新药物、新技术的不断涌现,近年来HR+/HER2-晚期乳腺癌的治疗已经进入“满园春色、百花齐放”的新局面,2022年SABCS大会上不乏在HR+/HER2-晚期乳腺癌中取得突破性进展的成果展示。特别邀请到中国医学科学院肿瘤医院肿瘤内科的马飞教授,将相关亮点研究进行盘点解读,以飨读者。
拓宽边界——CDK4/6抑制剂+内分泌治疗稳居标准一线治疗地位
对于HR+/HER2-晚期乳腺癌,《中国晚期乳腺癌规范诊疗指南(2022版)》推荐不合并内脏危象的患者可以优先选择CDK4/6抑制剂+内分泌治疗[2]。既往多项临床研究共同证实了该方案的显著治疗获益,目前CDK4/6抑制剂+氟维司群/芳香化酶抑制剂(AI)已成为不合并内脏危象HR+/HER2-晚期乳腺癌患者的标准一线治疗选择。
内脏危象并非单纯指存在内脏转移,而是指危重的内脏等疾病情况需快速有效的治疗以控制疾病进展,尤其是指一旦进展后就失去进一步治疗机会的情况。既往应用CDK4/6抑制剂联合内分泌治疗合并内脏危象HR+/HER2-晚期乳腺癌的数据相对有限,临床上往往优先给予化疗以达到快速起效并控制疾病的目的[2]。
随着研究的深入,已有数据显示内分泌联合靶向治疗的疾病控制率和PFS并不亚于化疗,不少专家认为,即使对于一些肿瘤负荷较大的乳腺癌患者(如伴有内脏转移),内分泌联合靶向治疗CDK4/6抑制剂也可作为治疗选择[3]。对于内脏危象患者,尽管指南上一般推荐优选化疗,但是目前尚缺乏CDK4/6抑制剂联合内分泌和化疗的头对头临床研究。2022年SABCS大会公布的RIGHT Choice研究[4]旨在探索包括内脏转移在内的肿瘤负荷较高的患者的最佳治疗模式,这项国际多中心随机非盲二期临床研究共入组侵袭性HR+/HER2-晚期乳腺癌(伴侵袭性病变定义为:有症状的内脏转移、疾病快速进展或邻近内脏损害、症状显著的非内脏转移)、尚未接受全身治疗的绝经前或围绝经患者222例,其中112例接受Ribociclib+来曲唑或阿那曲唑+戈舍瑞林,其余110例给予医生选择的联合化疗。

图1. RIGHT Choice研究设计
结果表明Ribociclib+内分泌治疗组与联合化疗组相比,中位PFS显著延长11.7个月(24.0个月 vs 12.3个月),疾病进展或死亡风险降低46%。中位至治疗失败时间延长10.1个月(18.6个月 vs 8.5个月)。这是首个针对HR+/HER2-晚期乳腺癌合并内脏危象或高侵袭性病变绝经前患者,对比CDK4/6抑制剂+内分泌治疗与联合化疗一线治疗疗效的前瞻性临床试验,研究结果提示不管是否合并内脏危象,CDK4/6抑制剂+内分泌治疗都优于联合化疗,这项研究结果或将进一步拓宽CDK4/6抑制剂联合内分泌治疗的一线获益人群。
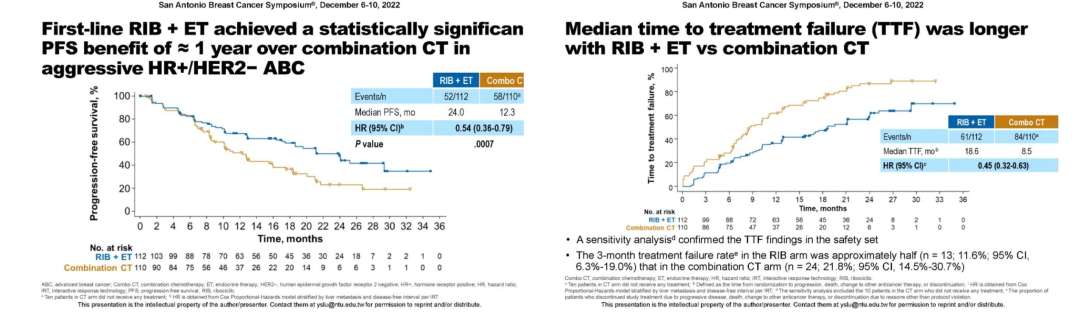
图2. PFS和TTF
百花齐放——以内分泌治疗为基础的post-CDK4/6抑制剂治疗方案探索不断
尽管CDK4/6抑制剂+氟维司群/AI作为标准一线治疗,显著改善了HR+/HER2-晚期乳腺癌的生存获益,但是患者终究会面临耐药进展。由于内分泌耐药的乳腺癌仍然依赖于ER的信号传导来介导肿瘤的生长和生存[5],因此以内分泌为基础的治疗方案仍是临床上的重要管理策略。虽然目前对于CDK4/6抑制剂治疗后进展的HR+/HER2-晚期乳腺癌,尚缺乏标准的治疗方案。但从近年来的研究进展来看,包括PI3K/AKT/mTOR抑制剂+内分泌治疗、口服选择性雌激素受体下调剂(SERD)、PROTAC蛋白降解剂等以内分泌为基础的新型治疗策略,均在CDK4/6抑制剂治疗进展后的HR+/HER2-乳腺癌治疗领域展开了积极探索,并在本次大会上携最新成果惊艳亮相。
CAPItello-291研究—为Capivasertib成为全球首个AKT抑制剂提供充分循证
Capivasertib是针对AKT全部亚型(AKT1,2,3)的强效选择性抑制剂,临床前研究表明Capivasertib与氟维司群在内分泌敏感及耐药的ER阳性乳腺癌模型中均具有协同作用[6]。其Ⅱ期FAKTION研究也已经证实,与氟维司群单药相比,Capivasertib+氟维司群可显著延长AI耐药患者的PFS[7]。CAPItello-291研究[8]是一项随机、双盲、安慰剂对照III期临床研究,旨在评估Capivasertib+氟维司群用于AI耐药的HR+/HER2-晚期乳腺癌的疗效与安全性。该研究共招募708例绝经前/绝经后女性及男性HR+/HER2-晚期乳腺癌患者,所有患者均在晚期阶段AI治疗中发生进展、或辅助阶段应用AI治疗中或治疗后12个月内出现疾病复发,且既往化疗线数≤1,既往内分泌治疗线数≤2。研究以总体人群和伴有AKT通路异常(至少携带一种PIK3CA、AKT1或PTEN基因突变)患者的PFS(研究者评估)作为双重主要研究终点。

图3. CAPItello-291研究设计
截止2022年8月15日,在总人群中报告了551例无进展生存事件。Capivasertib+氟维司群相比安慰剂+氟维司群,显著改善总人群的中位PFS(7.2个月 vs 3.6个月)。进一步分析显示,不管是伴有AKT通路异常的患者(7.3个月 vs 3.1个月),还是不伴有AKT通路异常的患者(7.2个月 vs 3.7个月,),Capivasertib+氟维司群组的中位PFS都有显著获益。该研究不仅达到双重主要研究终点,且PFS获益不受是否存在肝转移以及是否应用CDK4/6抑制剂(研究共纳入69%的CDK4/6抑制剂经治患者)的影响。此外,OS分析结果显示,在总人群及伴有AKT通路异常患者中,相比于对照组,Capivasertib+氟维司群组均具有改善OS的趋势,死亡风险分别降低26%和31%。
研究中总体安全性良好,既往在其他PI3K/AKT/mTOR抑制剂中观察到的严重高血糖及口腔炎等不良事件,在Capivasertib+氟维司群联合方案中鲜有发生。CAPItello-291研究是AKT抑制剂+内分泌治疗领域的首个III期临床研究,基于该研究突破性的治疗获益,以及良好的安全性特征,使得Capivasertib+氟维司群有望成为post-CDK4/6抑制剂的标准治疗选择。
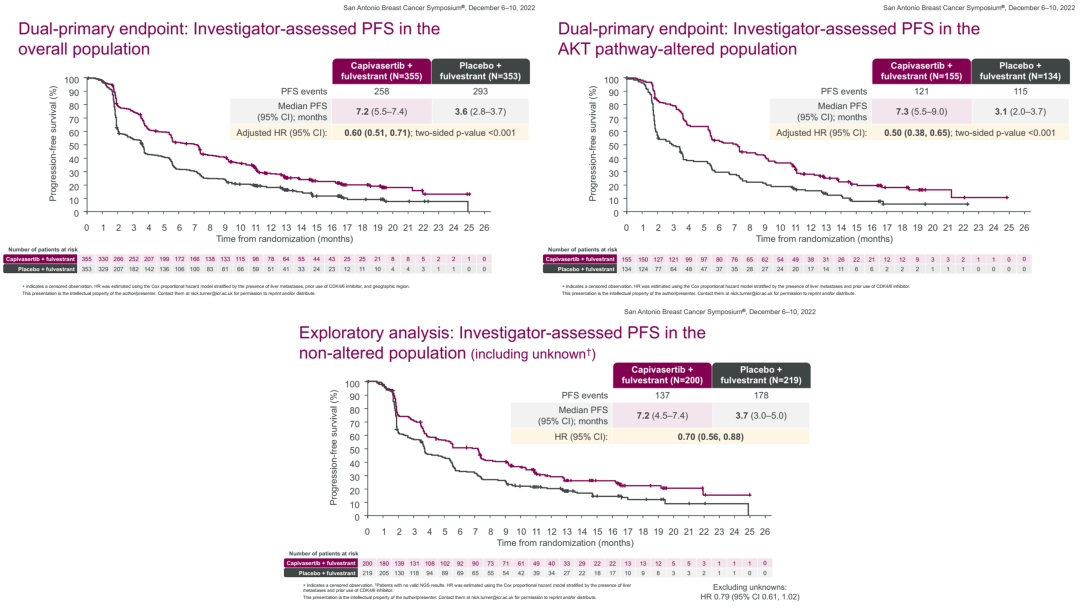
图4. 总人群、伴或不伴AKT突变患者的PFS
SERENA-2研究——首次验证Camizestrant头对头对比氟维司群的治疗有效性
Camizestrant是新一代口服非甾体类SERD,既能抑制ERα驱动的肿瘤细胞生长,又能导致ERα受体的降解[9]。既往Ⅰ期SERENA-1研究[10]中,Camizestrant单药或与CDK4/6抑制剂联合给药已经展现出极具前景的抗肿瘤活性,并且总体耐受性良好。SERENA-2研究[11]是一项多中心、随机、开放标签的Ⅱ期临床试验,在晚期ER+/HER2-乳腺癌患者中评估不同剂量水平Camizestrant(75mg、150mg、300mg)相比氟维司群的疗效和安全性。该研究纳入既往在晚期阶段接受过≤1线内分泌治疗和≤1线化疗的ER+/HER2-绝经后晚期乳腺癌女性患者。根据既往是否接受过CDK4/6抑制剂治疗以及是否伴有肺/肝转移进行分层,进一步探索Camizestrant的优势人群。
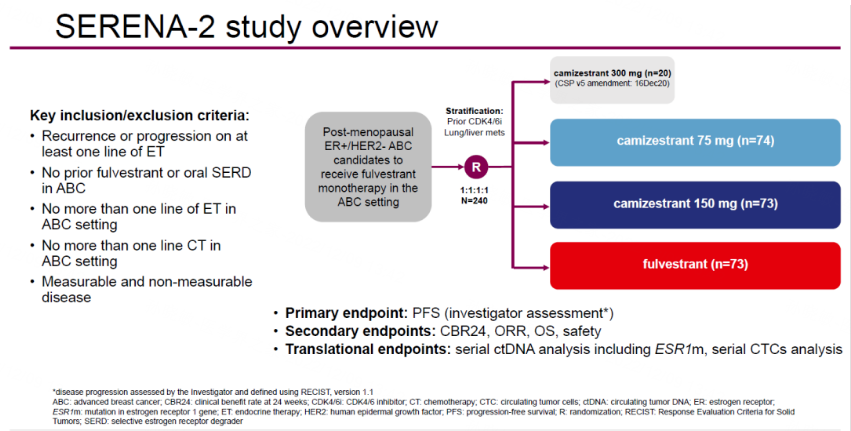
图5. SERENA-2研究设计
2022年SABCS大会公布的结果显示SERENA-2研究达到主要终点。在总人群中,与氟维司群相比,两种剂量Camizestrant均可使PFS产生具有统计学意义和临床意义的改善,75mg组、150mg组和氟维司群组的中位PFS分别为7.2个月、7.7个月和3.7个月。亚组分析显示,在既往接受CDK4/6抑制剂治疗、伴肺/肝转移、ESR1突变以及有ER驱动疾病的亚组中,PFS获益趋势与总人群一致。本次更新的SERENA-2研究首次将Camizestrant与氟维司群进行头对头比较,并且在绝经后ER+/HER2-晚期乳腺癌患者中显示出优于氟维司群的PFS获益,研究结果充分表明Camizestrant有望成为针对ER+/HER2-晚期乳腺癌的更加有效且便捷的治疗选择。
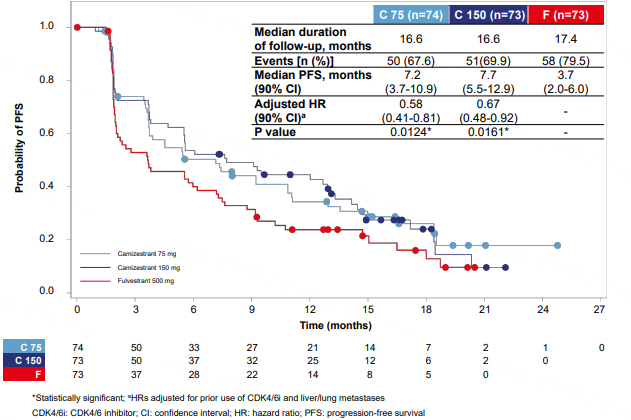
图6. 75mg组、150mg组Camizestrant和氟维司群组的PFS
EMERALD研究——Elacestrant的PFS获益与既往CDK4/6抑制剂使用时间成正相关
Elacestrant是另一种研发进程相对较为顺利的新型口服非甾体类SERD,本次SABCS大会公布了Elacestrant的EMERALD研究更新数据[12],EMERALD是一项多中心、随机、开放标签、对照、III期临床试验,研究纳入既往接受过1或2次内分泌治疗的患者,所有患者均接受过CDK4/6抑制剂治疗。随机分配至Elacestrant和标准内分泌治疗组(SOC)。
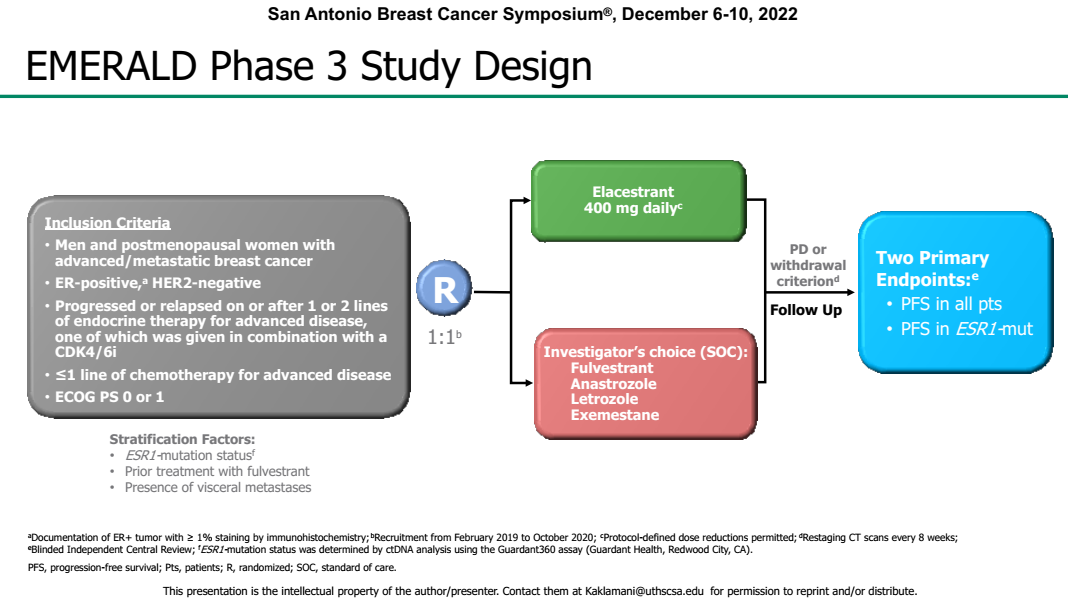
图7. EMERALD研究设计
根据2022年SABCS大会公布的结果显示,在总人群(n=478)和ESR1突变患者(n=228)中,Elacestrant相比标准内分泌治疗均显著改善中位PFS,且PFS获益与既往CDK4/6抑制剂的治疗时间呈正相关,既往CDK4/6抑制剂的使用时间分别至少为6个月、12个月和18个月时,Elacestrant组的中位PFS分别为2.79个月、3.78个月、5.45个月。且在ESR1突变患者中更为明显,相应中位PFS分别为4.14个月、8.61个月、8.61个月。
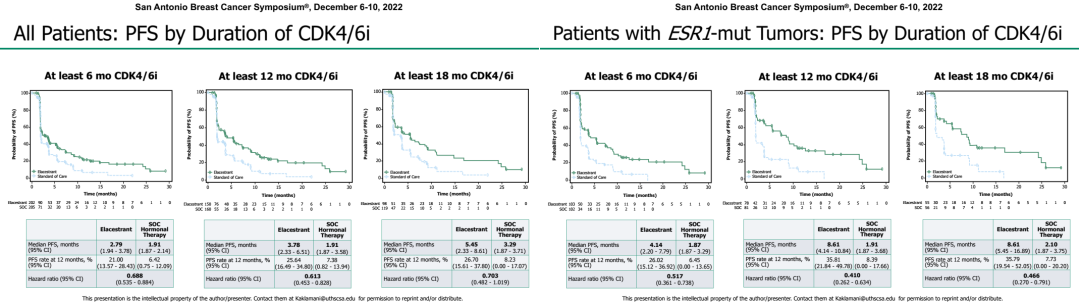
图8. 按照既往CDK4/6抑制剂分层的PFS(总人群和ESR1突变患者)
VERITAC研究——ARV-471或能进一步丰富CDK4/6抑制剂经治后HR+/HER2-晚期乳腺癌治疗选择
ARV-471是一种选择性口服PROTAC蛋白降解剂,靶向野生型和突变型ER。ARV-471直接结合E3泛素连接酶和ER,以触发ER的泛素化及其随后的蛋白酶体降解[13]。一项首次在人体中进行的、开放标签、3部分、I/II期研究 (NCT04072952) ,旨在评价ARV-471在ER+/HER2-局部晚期或转移性乳腺癌患者中的疗效和安全性[13]。研究的II期扩展部分(VERITAC)入组既往接受过≥1种内分泌治疗≥6个月、≥1种CDK4/6抑制剂和≤1种化疗方案的ER+/HER2-局部晚期/转移性乳腺癌患者接受ARV-471单药治疗,剂量为200 mg每日一次(QD)或500 mg QD。
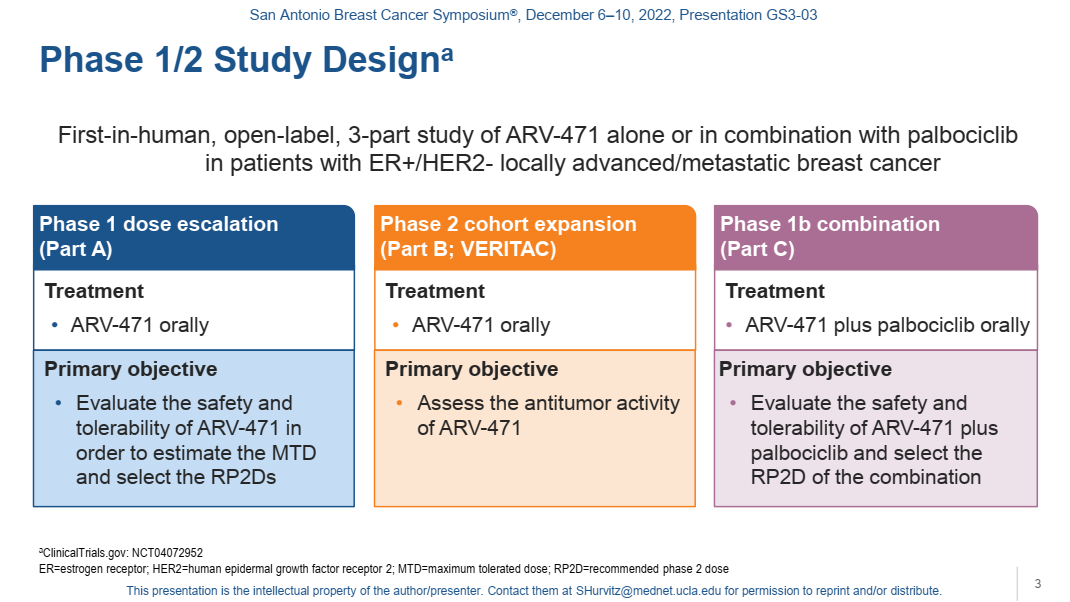
图9. I/II期研究设计
截至2022年06月06日,共71例患者接受了ARV-471治疗。100%的患者既往接受过CDK4/6 抑制剂。ARV-471在两种剂量下均耐受性良好,大多数治疗相关不良事件 (TRAE) 为1/2级;最常见的TRAE为疲乏和恶心。
200 mg QD组:CBR为37.1%,中位PFS为3.5个月,ESR1突变患者(n=19)的中位PFS为5.5个月,CBR为47.4%。
500 mg QD组:CBR为38.9%。ESR1突变(n=22)患者的CBR为54.5%。
VERITAC扩展队列结果表明在既往接受过CDK4/6抑制剂治疗的ER+/HER2-局部晚期/转移性乳腺癌患者中,ARV-471单药治疗显示出较强的CBR,并且在ESR1突变亚组中进一步增强,有望进一步丰富post-CDK4/6抑制剂的临床治疗策略。
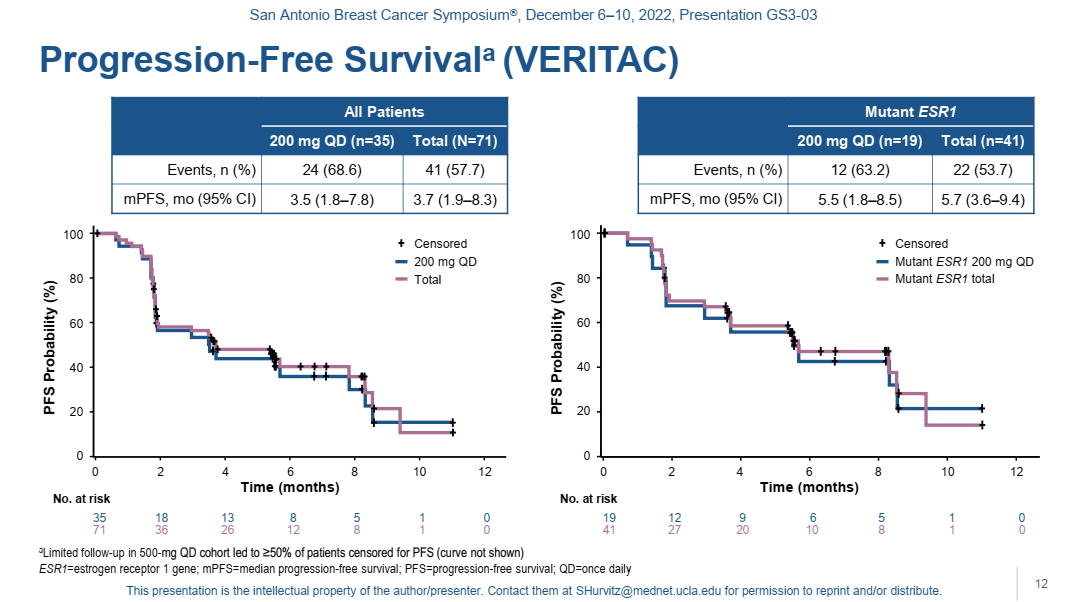
图10. II期扩展部分 (VERITAC)的PFS(总人群和ESR1突变患者)
保驾护航——新型ADC药物为内分泌抵抗或快速进展人群带来新希望
内分泌治疗的基础在于抑制ER的产生或阻止ER与其受体的结合,尽管大多数HR+/HER2-晚期乳腺癌患者都能受益于内分泌治疗,预后得到长足改善。但仍然存在由肿瘤微环境中发生的各种复杂变化驱动的内分泌治疗原发(新发)或继发性耐药的临床障碍。并且,在接受其他以内分泌治疗为基础的方案治疗后,这种耐药性也可能持续存在[14]。不仅如此,内分泌治疗通常适合于肿瘤进展缓慢的晚期乳腺癌患者,对于肿瘤快速进展的人群,需要给予有效且能快速缓解疾病的治疗方法[5]。进一步探索针对HR+/HER2-晚期乳腺内分泌抵抗或快速进展患者的治疗方案就显得尤为必要。
得益于精准靶向、高效低度的独特属性,近年来,ADC药物的发展十分迅猛。尤其在HER2阳性晚期乳腺癌治疗领域,新型ADC药物T-DXd凭借史无前例的疗效突破,成功重塑乳腺癌治疗新格局。并且以之为代表的新型ADC药物不断拓展乳腺癌获益人群边界,在HR+/HER2-乳腺癌治疗领域积极布局,掀起了乳腺癌ADC药物治疗的新浪潮。
DESTINY-Breast04研究—T-DXd将成为HR阳性HER2低表达乳腺癌的首个标准治疗选择
T-DXd是由曲妥珠单抗和高活性拓扑异构酶I抑制剂通过可裂解四肽连接子偶联而成的新型ADC药物,得益于连接子可裂解、载药的膜渗透性,以及药物抗体比(DAR)高达8的机制特性,T-DXd具有强效旁观者效应,针对HER2低表达乳腺癌也能发挥强大的抗肿瘤作用[15]。HER2低表达约占HR+/HER2-乳腺癌的65.4%[16],DESTINY-Breast04研究已经充分验证了T-DXd在HER2低表达乳腺癌(无论HR状态如何)中的治疗获益,在这项首个针对HER2低表达乳腺癌进行的随机III期临床试验中,评估了T-DXd对比研究者选择的化疗(TPC)治疗既往接受过1-2线化疗的HER2低表达不可切除和/或转移性乳腺癌患者。患者以2:1的比例随机接受T-DXd(373例,HR阳性331例)或TPC(184例,HR阳性163例)治疗。在HR阳性患者人群中,两组纳入的CDK4/6抑制剂经治患者比例分别为70%和71%。
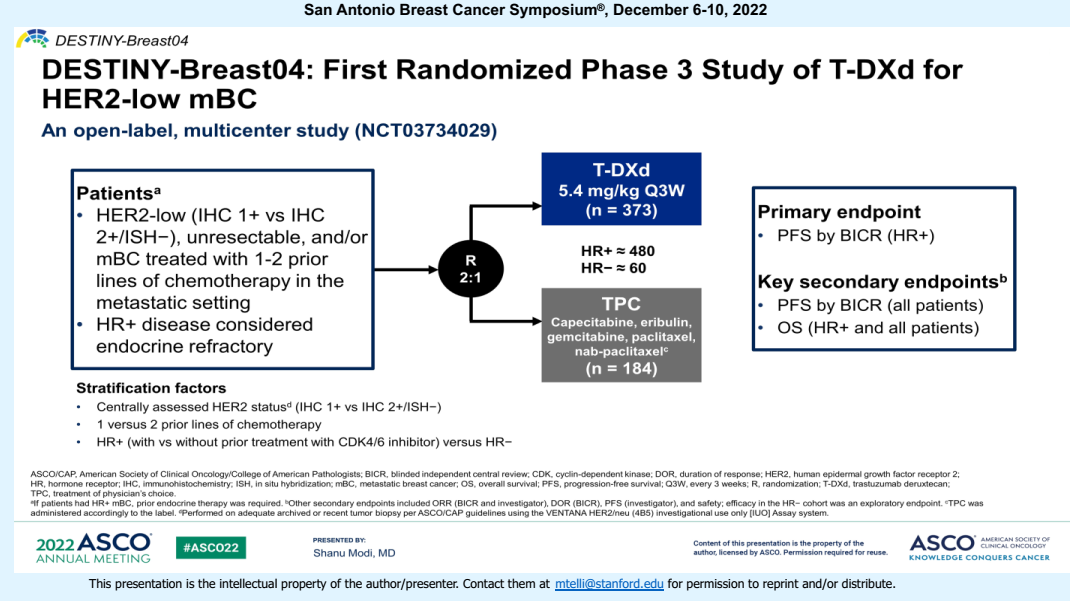
图11. DESTINY-Breast04研究设计
2022年ASCO大会首次公布研究成果,且同步发表于《新英格兰医学杂志》[17]。HR阳性HER2低表达乳腺癌患者中:
经BICR评估的中位PFS,T-DXd组为10.1个月,约为化疗组(5.4个月)的2倍,疾病进展或死亡风险降低49%。
在关键次要终点OS方面,HR阳性患者中两组的中位OS分别为23.9个月和17.5个月,死亡风险降低36%。
此外,T-DXd组的ORR达到52.6%,提示低表达患者能获得持续而有深度的疾病缓解。
DB04研究的重磅发布打破了传统抗HER2靶向治疗仅针对HER2阳性乳腺癌治疗有效的局限,使得HER2低表达成为新的抗HER2靶向治疗获益人群。并且基于DB04研究的突破性成果,T-DXd或将成为首个针对HER2低表达乳腺癌的标准治疗选择。
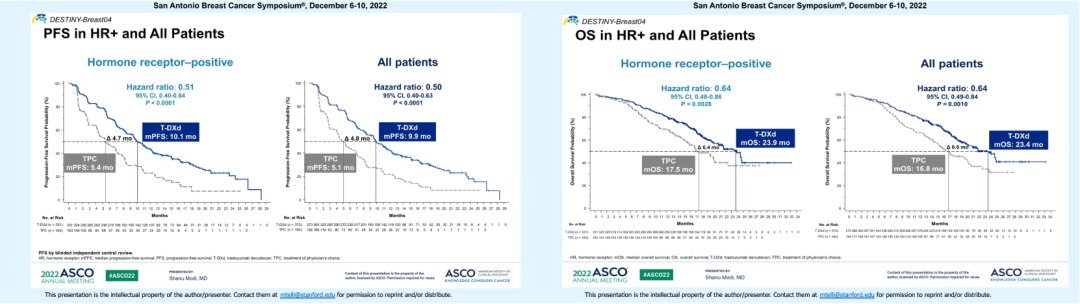
图12. HR阳性和总人群的PFS和OS
2022年SABCS大会公布了DB04研究的亚组分析数据[18],包括是否CDK4/6抑制剂经治、不同疾病负荷状态(低:0-2;高:3个及以上转移灶)、疾病是否快速进展、基线是否脑转移等亚组均显示出与总体人群一致的获益趋势。其中CDK4/6抑制剂经治亚组(HR阳性人群)的中位PFS,T-DXd和TPC组分别为10.0个月和5.4个月,并且两组的ORR分别为50.6%和13.0%,T-DXd组均显示出明显获益优势。结果充分提示T-DXd或将成为CDK4/6抑制剂经治HR阳性HER2低表达晚期乳腺癌患者的新型治疗选择。

图13. 是否CDK4/6抑制剂经治HR阳性患者的PFS
TROPiCS-02研究—SG针对CDK4/6抑制剂经治后HR+/HER2-晚期乳腺癌具有明显治疗获益
戈沙妥珠单抗(SG)由人源化抗Trop-2抗体和同为拓扑异构酶I抑制剂的载药SN-38通过pH敏感可裂解连接子CL2A偶联而成,其DAR为7.6,同样具有旁观者效应[19],并且是目前国内外首个获批的Trop-2靶向ADC药物。TROPiCS-02是一项全球性、多中心、开放标签的临床III期试验,共纳入543例HR+/HER2-转移性乳腺癌患者,按照1:1的比例随机分配至SG组或TPC组。入组患者既往曾接受过至少1种内分泌药物和1种CDK4/6抑制剂、1种紫杉类药物的治疗,并在转移性阶段接受过2-4线化疗。

图14. TROPiCS-02研究设计
结果显示,在ITT人群中,SG组的中位PFS为5.5个月,显著优于化疗组的4.0个月[20]。2022年ESMO大会公布的数据显示[21],两组的中位OS分别为14.4个月和11.2个月,SG组同样表现出具有统计学意义的优势。2022年SABCS大会公布了该研究按照TROP-2表达(免疫组化评估肿瘤细胞表面的TROP-2表达,表示为H-score;范围0-300)分层的治疗获益[22],数据显示:
H-score<100亚组中,SG相比TPC组的中位PFS为5.3个月 vs 4.0个月,中位OS为14.6个月 vs 11.3个月;
H-score≥100亚组中,中位PFS为6.4个月 vs 4.1个月,中位OS为14.4个月 vs 11.2个月。
不同TROP-2表达亚组均观察到与总人群一致的获益。研究结果同样表明SG是针对CDK4/6抑制剂治疗进展后HR+/HER2-晚期乳腺癌的有效治疗选择,且不依赖于TROP-2表达状态的检测。
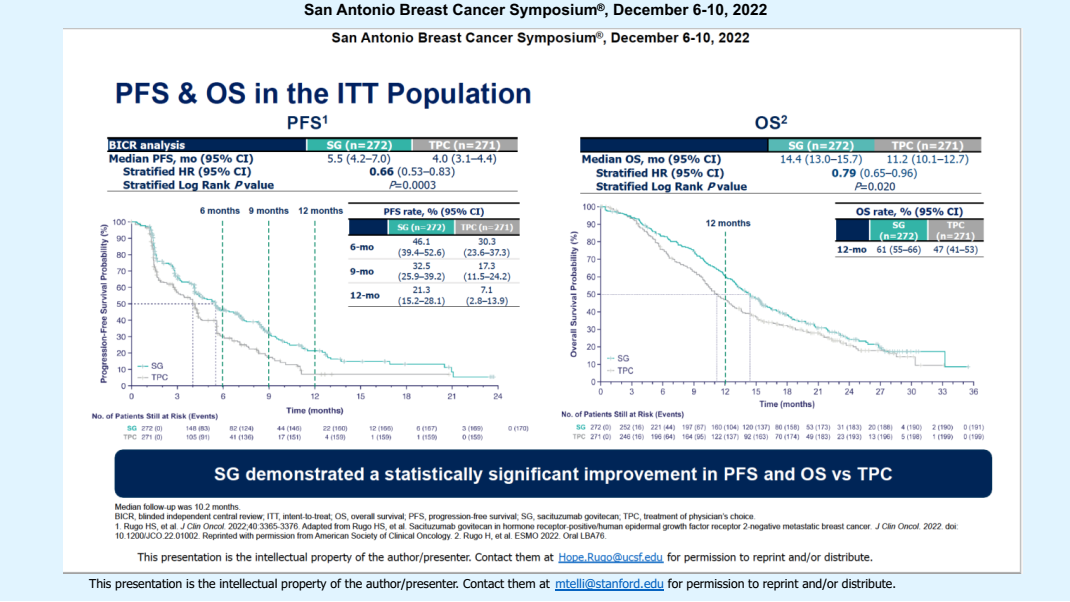
图15. ITT人群的PFS和OS
TROPION-PanTumor01研究——Dato-DXd针对CDK4/6抑制剂经治后HR+/HER2-晚期乳腺癌疗效与安全性俱佳
Dato-DXd是基于DXd技术平台的第二款新型ADC药物,由人源化抗TROP-2 IgG1抗体通过稳定的、肿瘤选择性的、基于四肽的可裂解连接子,与高活性拓扑异构酶I抑制剂载药共价连接。尽管Dato-DXd与T-DXd具有相同的载药和连接子,但由于TROP-2在正常组织中相对高表达,为了平衡ADC药物的疗效和安全性,将其DAR优化为4[23]。TROPION-PanTumor01是一项I期、多中心、开放标签、两阶段剂量递增/扩展研究,既往该研究已经公布在NSCLC患者中的临床获益,目前正在评估Dato-DXd在接受过标准治疗后进展的、不可切除或转移的HR+/HER2−晚期乳腺癌患者中的疗效和安全性。

图16. TROPION-PanTumor01研究设计
2022年SABCS大会公布的结果显示[23],数据截止2022年07月22日,41例HR+/HER2-乳腺癌患者接受了Dato-DXd治疗,针对转移性疾病的中位既往治疗线数为5,95%的患者既往接受过CDK4/6抑制剂辅助治疗或治疗转移性疾病。BICR评估确认的ORR为27%,DCR为85%,CBR为44%。中位PFS为8.3个月。未达到中位OS,59%的患者存活&1年。结果表明在既往已接受过大量治疗的患者中,应用Dato-DXd可获得令人鼓舞的疾病缓解和生存改善,表现出可控的安全性特征和良好的抗肿瘤活性。
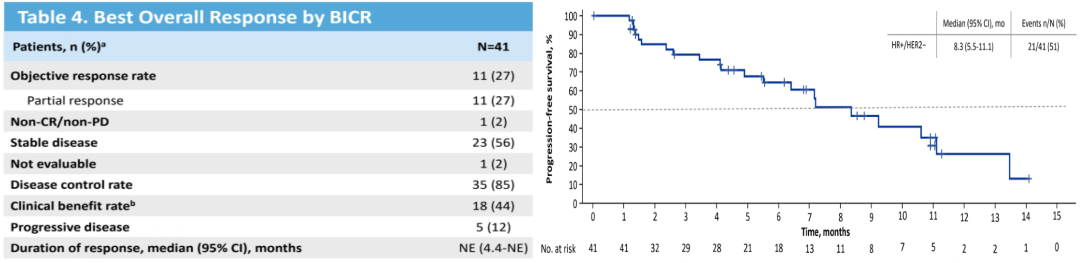
图17. BICR评估的疾病缓解情况以及PFS
总结
CDK4/6抑制剂+内分泌治疗已经成为不合并内脏危象HR+/HER2-晚期乳腺癌患者的标准一线治疗选择,而随着RIGHT Choice研究结果的披露,对于合并内脏危象的患者,CDK4/6抑制剂+内分泌治疗也或将成为优选。随着CDK4/6抑制剂+内分泌治疗越来越广泛用于HR+/HER2-晚期乳腺癌患者的一线治疗,post-CDK4/6抑制剂治疗方案的探索已然成为临床上亟待解决的问题。令人欣慰的是诸如PI3K/AKT/mTOR抑制剂、口服SERD以及PROTAC等新型药物不断涌现,并且在CDK4/6抑制剂经治患者群体中取得了非常振奋人心的研究结果,尤其是全球首个AKT抑制剂Capivasertib更是有望从系列研究药物中脱颖而出,或将成为post-CDK4/6抑制剂的标准治疗选择。同时,对于接受以内分泌治疗为基础的方案后仍然疾病进展,或者肿瘤快速进展不适合接受内分泌治疗的人群而言,新型ADC药物凭借强大的临床获益,无疑为这类患者带来了新的治疗希望,不仅为进一步克服乳腺癌内分泌治疗耐药难题提供了有效解决方案,更是有助于全方位、多线覆盖HR+/HER2-晚期乳腺癌治疗获益人群,为开创新的乳腺癌治疗格局保驾护航。
专家简介

马飞 教授
中国医学科学院肿瘤医院
主任医师、教授、博士生导师、长江学者特聘教授
国家癌症中心/中国医学科学院肿瘤医院内科治疗中心主任
国家抗肿瘤药物临床应用监测专委会秘书长
国家肿瘤质控中心乳腺癌专委会副主委
国家癌症中心乳腺癌筛查与早诊早治规范委员会秘书长
健康中国行动推进委员会入库专家
中国药师协会肿瘤专科药师分会副主委
中国抗癌协会整合肿瘤心脏病分会副主委
中国抗癌协会多原发和不明原发肿瘤专委会副主委
中国抗癌协会肿瘤药物临床研究专委会秘书长
全国女性卵巢保护与抗衰促进工程专委会副主委
中国老年学和老年医学学会老年肿瘤分会总干事长
北京乳腺病防治学会副理事长
北京市肿瘤治疗质量控制和改进中心肿瘤化疗质控专委会主委等职
Cancer Innovation主编
获得国家科技进步奖二等奖,及“首都十大杰出青年医生”、“中国肿瘤青年科学家奖”等荣誉称号。
参考文献:
[1].Chen Z, Ouyang Q, Wang Y, et al. Real-World First-Line Treatment Patterns and Outcomes in Hormone Receptor-Positive Advanced Breast Cancer Patients: A Multicenter, Retrospective Study in China. Front Oncol. 2022 Mar 3;12:829693.
[2].《中国晚期乳腺癌规范诊疗指南(2022版)》
[3].《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022》
[4].Lu YS, Mohd Mahidin BEL, Azim H, et al. Primary results from the randomized Phase II RIGHT Choice trial of premenopausal patients with aggressive HR+/HER2− advanced breast cancer treated with ribociclib + endocrine therapy vs physician’s choice combination chemotherapy. 2022 SABCS. GS1-10.
[5].Nardone A, De Angelis C, Trivedi MV, et al. The changing role of ER in endocrine resistance. Breast. 2015 Nov;24 Suppl 2(0 2):S60-6.
[6].Jones RH,Casbard A,Carucci M,et al.Fulvestrant plus capivasertib versus placebo after relapse or progression on an aromatase inhibitor in metastatic,oestrogen receptor-positive breast cancer(FAKTION):a multicentre,randomised,controlled,phase 2 trial.Lancet Oncol.2020 Mar;21(3):345-357.
[7].Jones RH,Casbard AC,Carucci M,et al.Fulvestrant plus capivasertib versus fulvestrant plus placebo after relapse or progression on an aromatase inhibitor in metastatic,estrogen receptor–positive breast cancer(FAKTION):Overall survival and updated progression-free survival data with enhanced biomarker analysis.ASCO 2022.Abs 1005.
[8].Turner NC,Oliveira M,Howell S,et al.Capivasertib and fulvestrant for patients with aromatase inhibitor-resistant hormone receptor-positive/human epidermal growth factor receptor 2-negative advanced breast cancer:results from the Phase III CAPItello-291 trial.2022 SABCS.GS3-04.
[9].Scott JS, Moss TA, Balazs A, et al. Discovery of AZD9833, a Potent and Orally Bioavailable Selective Estrogen Receptor Degrader and Antagonist. J Med Chem. 2020 Dec 10;63(23):14530-14559.
[10].Oliveira M, Hamilton EP, Incorvati J, et al, Serena-1: Updated analyses from a phase 1 study (parts C/D) of the next-generation oral SERD camizestrant (AZD9833) in combination with palbociclib, in women with ER-positive, HER2-negative advanced breast cancer. Journal of Clinical Oncology 2022, 40(16_suppl): 1032-1032.
[11].Oliveira M, et al Camizestrant, a next generation oral SERD vs fulvestrant in post-menopausal women with advanced ER-positive HER2-negative breast cancer: Results of the randomized, multi-dose Phase 2 SERENA-2 trial. 2022 SABCS. GS3-02.
[12].Bardia A, Bardia FC, Neven k, et al. EMERALD phase 3 trial of elacestrant versus standard of care endocrine therapy in patients with ER+/HER2- metastatic breast cancer: Updated results by duration of prior CDK4/6i in metastatic setting. 2022 SABCS. GS3-01.
[13].Hurvitz SA, Schott AF, Ma C, et al. ARV-471, a PROTAC estrogen receptor (ER) degrader in advanced ER-positive/human epidermal growth factor receptor 2 (HER2)-negative breast cancer: phase 2 expansion (VERITAC) of a phase 1/2 study. 2022 SABCS. GS3-03.
[14].Rasha F, Sharma M, Pruitt K. Mechanisms of endocrine therapy resistance in breast cancer. Mol Cell Endocrinol. 2021 Jul 15;532:111322.
[15].Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
[16].Schettini F, Chic N, Brasó-Maristany F, et al. Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer. NPJ Breast Cancer. 2021 Jan 4;7(1):1.
[17].Modi S, Jacot W, Yamashita T, et al. DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
[18].Harbeck N, Modi S, Jacot W, et al.Trastuzumab Deruxtecan vs Treatment of Physician's Choice in Patients With HER2-Low Unresectable and/or Metastatic Breast Cancer: Subgroup Analvses From DESTINY-Breast04. 2022 SABCS. P1-11-01.
[19].Bardia A, Hurvitz SA, Tolaney SM, et al. ASCENT Clinical Trial Investigators. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541.
[20].Rugo HS, Bardia A, Marmé F, et al. Primary results from TROPiCS-02: A randomized phase 3 study of sacituzumab govitecan (SG) versus treatment of physician’s choice (TPC) in patients (Pts) with hormone receptor–positive/HER2-negative (HR+/HER2-) advanced breast cancer. presented at 2022 ASCO. LBA1001.
[21].Rugo HS, Bardia A, Marmé F, et al. Overall survival (OS) results from the phase III TROPiCS-02 study of sacituzumab govitecan (SG) vs treatment of physician's choice (TPC) in patients (pts) with HR+/HER2- metastatic breast cancer (mBC). presented at 2022 ESMO. LBA76.
[22].Rugo H, Bardia A, Marmé F, et al. Sacituzumab Govitecan (SG) vs Treatment of Physician’s Choice (TPC): Efficacy by Trop-2 Expression in the TROPiCS-02 Study of Patients (Pts) With HR+/HER2–Metastatic Breast Cancer (mBC). 2022 SABCS. GS5-11.
[23].Meric-Bernstam F, Krop IE, Juric D,et al. Phase 1 TROPION-PanTumor01 Study Evaluating Datopotamab Deruxtecan (Dato-DXd) in Unresectable or Metastatic Hormone Receptor-Positive/HER2-Negative Breast Cancer. 2022 SABCS. PD13-08.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |