
过氧化物酶体(peroxisome)是真核生物中广泛存在的一种由单层磷脂膜包裹的细胞器。其在细胞同化与异化代谢,以及氧化还原稳态的维持中发挥重要的作用。包括长链脂肪酸的氧化,活性氧的淬灭,以及缩醛磷脂的生物合成均发生在过氧化物酶体的基质内【1-2】。因此,过氧化物酶体功能的紊乱和缺失会导致多种人类疾病,其中最为常见的是Zellweger综合症【3】。近年来,过氧化物酶体的功能失调也被发现与肿瘤发生和多种神经退行性疾病有密切联系【4】。
过氧化物酶体的功能依赖于其基质中各类酶与其他蛋白质分子。这些蛋白先在细胞质中由核糖体合成,再跨膜转运进入细胞器的基质中,这一转运过程需要一系列由PEX基因编码的蛋白的协同作用。首先,货物蛋白上位于羧基端的信号肽(一般为S-K-L肽段)会被胞浆内的受体PEX5识别,进而被招募至位于过氧化物酶体表面的接驳复合物处(docking complex)【5】。其后,接驳复合物以某种未知机制协助受体PEX5和货物蛋白穿过膜并一同被释放进细胞器的基质中【6】。虽然货物蛋白会留在基质中,但PEX5则需要返回细胞质中进行下一轮转运,这一步骤是由膜内PEX2-PEX10-PEX12 组成的逆向转运复合物和位于过氧化物酶体表面的PEX1-PEX6 ATP酶复合物所先后介导完成的【7】(详情参考BioArt 先前报道:Nature | 丰培强等揭示过氧化物酶体蛋白转运新机制和Mol Cell | 基质蛋白摆渡者PEX5进出过氧化物酶体的机制)。值得一提的是,过氧化物酶体的货物蛋白能够以折叠或寡聚体的形式进行转运,这与蛋白转运进入内质网和线粒体的情形完全不同。因此,PEX5与货物蛋白需要一种新的解释机制来阐述跨膜转运的过程,而这是该领域内长期未能解决的重要议题。

2022年12月16日,来自哈佛大学医学院的Tom Rapoport (HHMI Investigator) 实验室在Science上发表了题为 Protein Import into peroxisomes occurs through a nuclear pore-like phase 的研究论文(高源博士和Michael L. Skowyra 博士为第一作者),发现并提出了一个全新的模型:与核孔蛋白转运中苯丙氨酸-甘氨酸重复序列(FG repeats)的功能类似,过氧化物酶体蛋白PEX13存在有保守的酪氨酸-甘氨酸(YG)结构域 。该结构域通过相分离在脂双层膜中形成网状结构,为蛋白转运提供通道。同时,结合货物蛋白的受体PEX5,通过与YG结构域的相互作用,最终融入并穿过网状结构,进入细胞器的内部。

研究者推测接驳复合物中的保守成员PEX13,相比较于另一保守成员PEX14,更具备作为跨膜转运通道的特征。他们发现在已知的PEX13同源序列中,均存在一段芳香族氨基酸富集(酪氨酸为主,苯丙氨酸为辅)的无序结构域。在芳香族氨基酸之间,有平均4个氨基酸长度的间隔序列,一般由小侧链的氨基酸(甘氨酸,丝氨酸)组成。因富含酪氨酸和甘氨酸,这一结构域遂被命名为YG结构域。YG结构域的特征与核孔蛋白中的FG重复序列整体相似,作者大胆推测YG结构域也可通过相互作用形成网状结构,作为蛋白转运的通道。在酵母中,当YG结构域中全部酪氨酸突变成丝氨酸后,蛋白转运完全中止;如果突变成苯丙氨酸,蛋白转运仅受部分影响,证实了YG结构域中的酪氨酸对于过氧化物酶体蛋白转运是必要的。进一步构建嵌合体菌株,将位于进化树不同分支的多个物种里的PEX13 YG结构域移植到酵母PEX13中。结果发现,这些长度和氨基酸构成均多样的序列仍然能在不同程度上支持蛋白转运,由此证明YG结构域的功能在进化上是保守的。
半胱氨酸介导的二硫键进行交联实验,结果发现,在分离的过氧化酶体中,两个PEX13分子中的YG结构域可高效地被交联在一起。在YG结构域中引入两个半胱氨酸,则可观察到超过8个分子的PEX13被交联在一起。如果将酪氨酸突变为丝氨酸,交联的效率则大大降低。因此,PEX13在过氧化物酶体上确实以寡聚体的形式存在,且每个单体中的YG结构域相互作用。
在核孔蛋白中,FG 重复序列可以形成阻隔大分子的网状结构,那么YG结构域是否具有类似的性质呢?作者在PEX13 中多个结构域内引入蛋白酶切位点,通过蛋白酶保护实验,证实了YG结构域相比于其上游的区域,能更有效地阻隔蛋白酶接近。其后,使用不同分子量的聚乙二醇-马来酰亚胺(PEG-maleimide)来修饰PEX13中引入的半胱氨酸,进一步发现YG结构域不能够被大分子量的聚乙二醇-马来酰亚胺(10kD 或5kD)接近,却可以被小分子量的聚乙二醇-马来酰亚胺(2kD或0.8kD)修饰。如果将酪氨酸突变为丝氨酸,YG 结构域的通透性会显著提高;如若突变为苯丙氨酸,则效果相反。这一系列结果均符合作者的推断,即PEX13寡聚体中的YG结构域形成了网状结构;且这一网状结构可以阻挡大分子通过,但同时允许小分子进入。
若要作为蛋白跨膜转运的通道,YG结构域形成的网状结构须嵌在过氧化物酶体的脂双层膜中。为了弄清YG结构域所处的位置,作者设计了一系列实验来探索PEX13的膜拓扑学特征。在旨在定位PEX13氨基端和羧基端的蛋白酶保护实验中,作者惊奇地发现,蛋白的两端均存在两种可能的朝向,其中一半面向胞浆,另外一半面向细胞器内部。随后,通过在PEX13唯一的跨膜区(TM)上下游引入蛋白酶切位点,作者进一步证实了PEX13的跨膜区的确存在两种相反的朝向,且二者比例约为1:1 。同时具备两种朝向的跨膜蛋白在真核生物中十分罕见,那么两种朝向对于转运功能都是必要的吗?处于不同朝向的PEX13分子会在一个复合物中同时存在吗?为了解决这个问题,作者巧妙地结合蛋白酶保护实验与半胱氨酸交联实验。先通过蛋白酶作用区分两种朝向的PEX13,再诱导位于YG结构域的半胱氨酸进行交联,最终发现任意两种朝向的PEX13分子均可以被有效地交联。这说明两种朝向的PEX13分子同时存在于一个寡聚复合物中。基于这一系列膜拓扑学的结论,作者认为来源于相反朝向PEX13的YG结构域能够在膜中相互作用,并被“悬挂”在脂双分子层中。

图一:纯化的YG结构域可以形成水凝胶
核孔蛋白中FG重复序列可以在体外实验中通过相分离形成水凝胶【8】,并且该水凝胶能够重现核孔运输蛋白的渗透过程【9】。因此,作者下一步试图在体外验证YG结构域是否也有类似的特性。通过筛选,作者成功表达并纯化了拟南芥PEX13中的YG结构域。当纯化后的蛋白被浓缩至2mM浓度时,溶液很快凝固,形成了水凝胶(图一)。而如果将YG结构域中的酪氨酸替换为丝氨酸,蛋白在相似条件下则不会形成水凝胶。接下来,作者使用荧光显微技术来追踪转运受体PEX5融入YG结构域水凝胶的情况。带有绿色荧光蛋白标签的PEX5在加入体系后,迅速富集在水凝胶的边界处并向内扩散,而绿色荧光蛋白自身或者是仅含有货物识别结构域的PEX5片段则没有出现明显的富集行为。作者发现PEX5融入并富集于水凝胶的能力依赖于其柔性氨基端中若干保守的五肽基序(WxxxF/Y motif),并推测该基序可以与YG结构域中的酪氨酸相互作用,从而局部扰乱网状结构,进而渗透至其内部。最后,作者进一步证实了PEX5还可以携带货物蛋白一起扩散并富集于YG结构域水凝胶中。
基于以上结果,作者提出了一种全新的过氧化物酶体蛋白转运通道的模型,来解释为何受体蛋白PEX5和处于折叠或寡聚体形式的货物蛋白能够跨膜转运的分子机制。处于两种膜朝向的PEX13分子在过氧化物酶体上形成寡聚体,其中的YG结构域则通过相分离形成能够阻隔大分子的网状结构,并选择性地允许受体PEX5和货物蛋白通过。作者还推测,PEX13中保守的两性螺旋结构(amphipathic helix)极可能构成转运通道的内壁(图二)。与核孔转运类似,PEX5与货物蛋白在网状结构中的渗透本身并不具有方向性。至此,作者进一步大胆推测接驳复合物中的另一成员PEX14,可依赖于其氨基端同PEX5 的高亲和力,帮助PEX5与货物蛋白进入基质。这一偏好过程又与其后的PEX5逆向转运相关联,使货物蛋白的转入与转出过程耦合在一起。
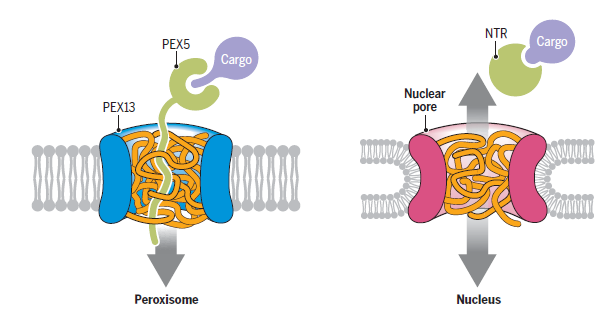
图二:过氧化物酶体蛋白转运通道与核孔运输通道的对比
这项研究解答了长期困扰该领域的重要问题,首次提出PEX13以寡聚体形式构成过氧化酶体蛋白转运的通道。PEX13中的YG结构域通过相分离在膜内形成网状结构,并选择性地允许受体PEX5和货物蛋白通过。该模型很好地解释了处于折叠或寡聚体形式的货物蛋白能够跨膜转运进入过氧化物酶体的现象,拓宽了学界对细胞中各类蛋白转运过程的认识。
核孔蛋白中FG重复序列形成网状结构来调节核孔运输,是生物相分离过程在细胞中应用的早期重大发现之一。本研究则揭示了细胞中另一重要的生理过程——过氧化物酶体蛋白转运——采用了相似却又不尽相同的机制,体现了细胞保守性和多样性的完美结合。特别一提的是,位于脂双分子层内部的、功能性的相分离结构是在细胞内首次被发现,进一步印证了相分离过程在细胞生理活动中的广泛存在。
哈佛医学院细胞生物学系Tom Rapoport教授为本文章的通讯作者。Tom Rapoport 课题组长期致力于细胞内各类蛋白转运过程机制的研究,近年来在多个领域均取得突破性进展。课题组现招收博士后研究员若干。
简历投递(有意者请将个人简历等材料发至):
https://jinshuju.net/f/ZqXwZt
原文链接:
http://doi.org/10.1126/science.adf3971
参考文献
1. I. J. Lodhi, C. F. Semenkovich, Peroxisomes: a nexus for lipid metabolism and cellular signaling. Cell Metab.19, 380–392 (2014).
2. C. Lismont, I. Revenco, M. Fransen, Peroxisomal Hydrogen Peroxide Metabolism and Signaling in Health and Disease. Int. J. Mol. Sci.20, 3673 (2019).
3. Y. Fujiki, Peroxisome biogenesis and human peroxisome-deficiency disorders. Proc. Jpn. Acad. Ser. B Phys. Biol. Sci. 92, 463–477 (2016).
4. Islinger, M., Voelkl, A., Fahimi, H.D. et al. The peroxisome: an update on mysteries 2.0 Histochem Cell Biol 150, 443–471 (2018).
5. V. C. Kalel, R. Erdmann, Unraveling of the Structure and Function of Peroxisomal Protein Import Machineries. Subcell. Biochem.89, 299–321 (2018).
6. M. L. Skowyra, T. A. Rapoport, PEX5 translocation into and out of peroxisomes drives matrix protein import. Mol. Cell, S1097-2765(22)00661-X (2022).
7. P. Feng, X. Wu, S. K. Erramilli, J. A. Paulo, P. Knejski, S. P. Gygi, A. A. Kossiakoff, T. A. Rapoport, A peroxisomal ubiquitin ligase complex forms a retrotranslocation channel. Nature.(2022), doi:10.1038/s41586-022-04903-x.
8. S. Frey, R. P. Richter, D. Görlich, FG-rich repeats of nuclear pore proteins form a three-dimensional meshwork with hydrogel-like properties. Science.314, 815–817 (2006).
9. S. Frey, D. Görlich, A Saturated FG-Repeat Hydrogel Can Reproduce the Permeability Properties of Nuclear Pore Complexes. Cell. 130, 512–523 (2007)


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |