*仅供医学专业人士阅读参考
撰文 | 苏旭晗
近日,美国国家综合癌症网络(NCCN)指南委员会发布了2023年第1版非小细胞肺癌临床实践指南。该指南基于新的临床研究证据,对非小细胞肺癌靶向治疗、诊断评估原则、病理学检查原则等多方面作出更新,现整理要点如下,以供参考。
难治靶点KRAS再迎新药
非小细胞肺癌(NSCLC)是肺癌中最常见的一种类型,大约占其患病总人群的80%-85%,多数NSCLC患者携带有不同的基因突变。KRAS为最常见的突变基因之一,KRAS G12C作为其中最主要的一种突变亚型,在NSCLC中占比高达25%[1]。
然而在KRAS靶点被发现后的40年里,没有任何一款靶向药物获批用于此类患者的临床治疗。直至2021年首款靶向药AMG-510获得美国食品药品监督管理局(FDA)批准上市,打破了KRAS靶点不可成药的僵局。
本次指南主要对肺癌驱动基因KRAS G12C突变的治疗方案作出补充更新,将2022年12月FDA批准的第二款KRAS G12C抑制剂Adagrasib (阿达格拉西布,MRTX849)写入指南推荐,为KRAS G12C突变患者再添用药新选择。
此次指南中关于Adagrasib的更新,主要基于一项代号为KRYSTAL-1的临床II期的多队列研究[2]。该研究旨在KRYSTAL-1-1b试验的基础上,评估Adagrasib用于KRAS G12C突变NSCLC患者的有效性和安全性。

研究发表截图
1
试验设计:
研究共纳入116例患有不可切除或转移性KRAS G12C突变,以及既往至少接受过一种铂类化疗和PD-1/L1抑制剂联合或续贯化疗的NSCLC成年患者,予以Adagrasib口服600mg/次,2次/日的方案治疗。
主要终点为经盲法独立中央审查评估的客观缓解率(ORR),次要终点为疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)。
安全性终点包括不良事件的类型、发生率、严重程度、时间和严重程度及其与研究药物的关系。
2
研究结果:
主要结局终点:
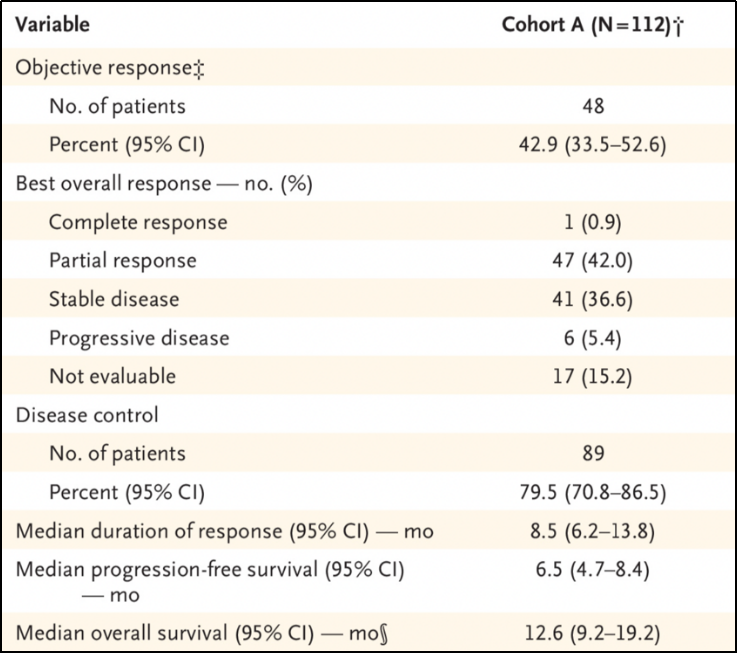
截至中位随访时间为12.9个月(95%CI, 11.8-13.5)时,112例基线可测量患者的ORR为42.9%(95%CI, 33.5%-52.6%)。见图1-A。
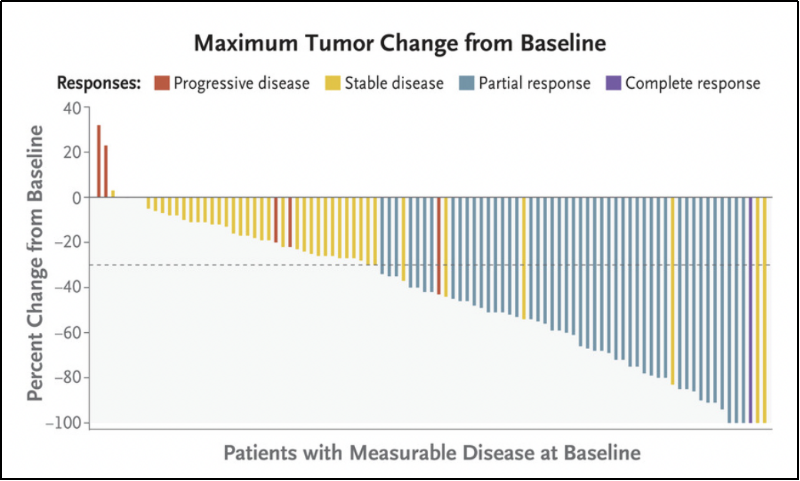
图1-A
其中包括1例患者完全缓解(CR, 0.9%)和47例部分缓解(PR, 42%);41例患者疾病稳定(SD, 36.6%),6例患者发生疾病进展(5.4%)。见表1。
表1 盲法独立评价的总体疗效总结
次要结局终点:
在48例客观缓解的患者中,中位缓解时间(TTR)为1.4个月(0.9-7.2),中位DOR为8.5个月(95%CI, 6.2-13.8)。数据截止时, 33.3%(n=16)的患者仍保持治疗反应。见图1-B。
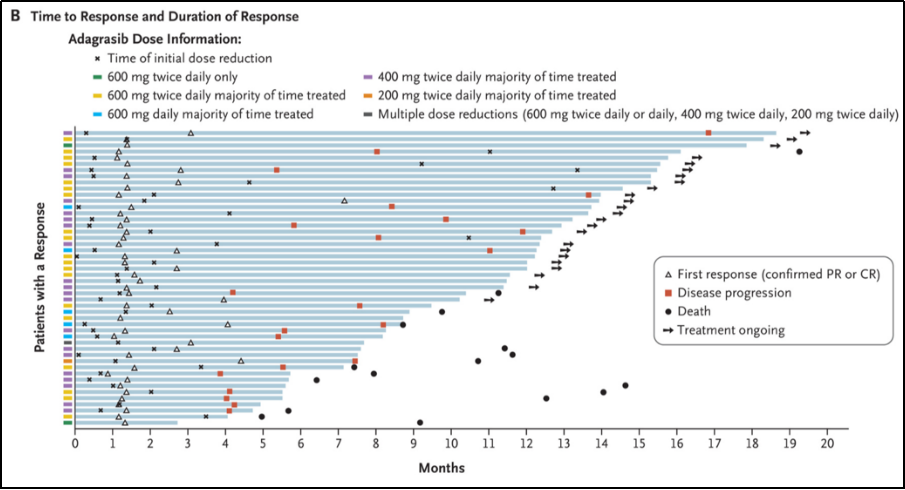
图1-B
112例可评估患者的中位PFS为6.5个月(95%CI, 4.7-8.4),6个月和12个月的PFS率分别为52%和29%。见图1-C。
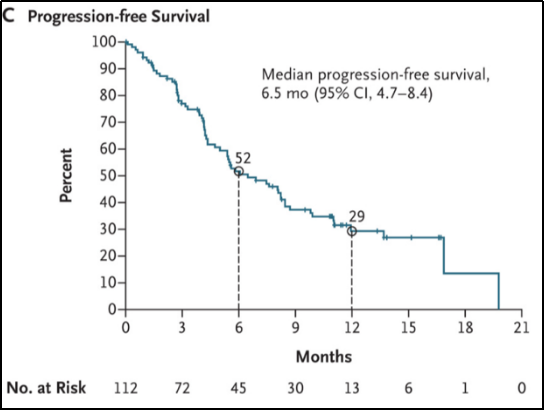
图1-C
中位随访时间至15.6个月时,中位OS为12.6个月(95%CI, 9.2-19.2),6个月和12个月的OS率分别为71%和51%。见图1-D。
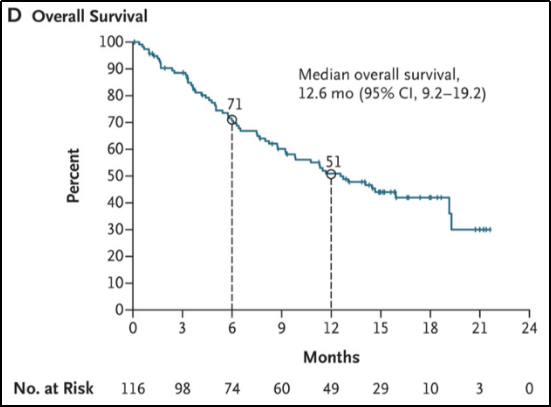
图1-D
亚组分析:
研究人员在试验中发现Adagrasib在脑转移的患者中表现良好,进行事后分析发现,33例可通过影像学评估的患者中,独立委员会评估的颅内ORR为33.3%(n=11, 95%CI, 18.8-51.8%),见图2。颅内中位DOR为11.2个月(95%CI, 2.99-不可评估);中位颅内PFS为5.4个月(95%CI, 3.3-11.6)。
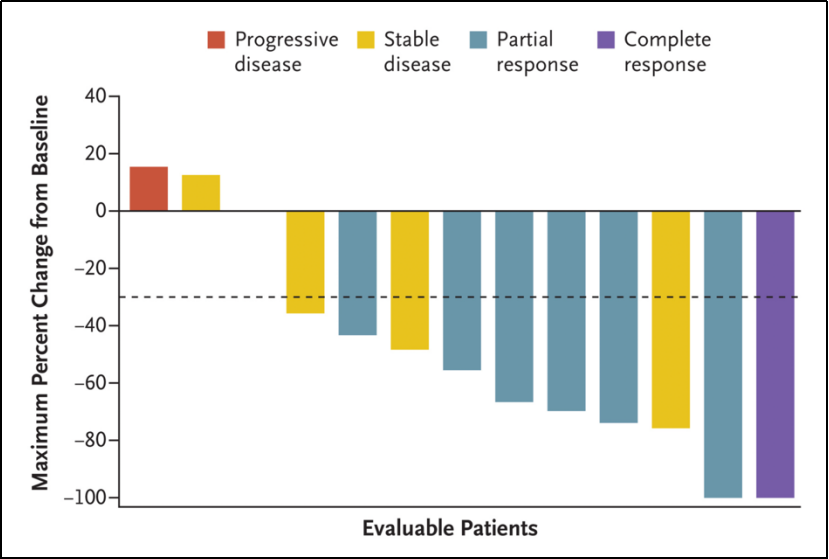
图2
安全性评价:
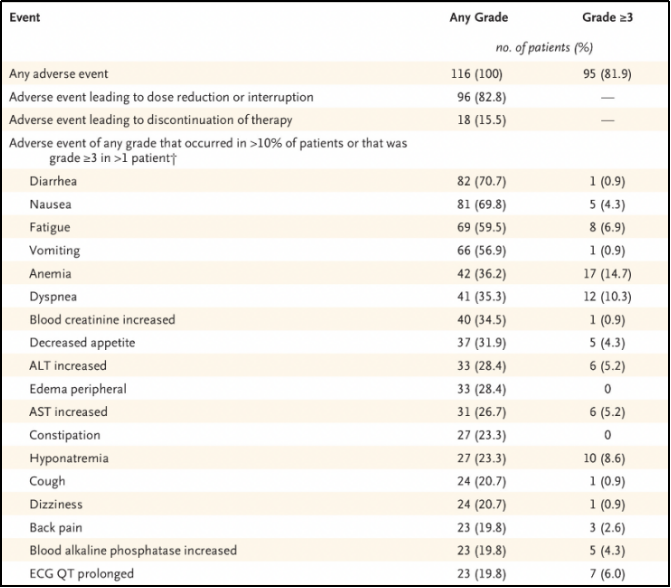
接受治疗的116例患者均发生了不同程度的不良事件,其中113例患者与治疗相关(TRAE);
52例患者(44.8%)发生的TRAE严重程度≥3级,最常见的的有疲劳、恶心、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)水平升高。共发生2例5级事件最终导致患者死亡,分别为心力衰竭和肺出血。
TRAE导致60例患者(51.7%)减量用药,71例患者(61.2%)用药中断,8例患者停药(7%)。见表2。
表2 治疗期间发生不良事件的部分截图
基于该项研究结果,Adagrasib被写入NCCN 2023 V1版指南中,与2021年首个获批上市的索托拉西布(Sotorasib)同作为KRAS G12C的共价抑制剂,用于先前接受过全身治疗的KRAS G12C突变的NSCLC患者。
值得一提的是,虽然Adagrasib取得了喜人的临床疗效,但也面临着由于较高的不良反应发生率导致用药中断、停药的情况,影响后续治疗。对于此,该研究组表示评估其他用药剂量(400mg/次,2次/日)的研究正在进行中。此外,中国地区的临床试验、研究、开发等也在同步进行,期待Adagrasib为难治靶点KRAS的治疗带来佳音。
诊断评估方面
肺癌患者术前活检与否的指导规定更精准。由于活检不仅耗费时间、费用,还会增加操作风险,因此减少不必要的活检操作无论对于患者还是临床决策者都具有十分重大的意义。
以往指南中表明,临床高度怀疑为“I/II期肺癌“的患者(基于风险因素和影像学表现),术前无需活检。新版指南中已将无需术前活检的范围精准到“IA期肺癌”患者。
支气管镜下能以无创的方法看到肺部的早期微小病变,清楚地观察肿瘤的部位和侵袭范围,同时可通过多种技术取得病理标本,对于后期医生制定准确的手术方案尤为重要。但是术前单独进行支气管镜检查增加时间、费用、操作风险成本,对于治疗决策而言可能是不需要的。
本次指南中也增加推荐条目,认为术前支气管镜检查可作为组织诊断和/或纵隔分期的首选(支气管内超声[EBUS])。
同时指南中也明确说明,对于既往未进行过用于诊断或分期的支气管镜检查,则应在计划的外科切除手术中进行,而非单独操作。
纵隔镜检查是诊断上纵隔淋巴结(N2~3)有无转移的最准确的手段,在肺癌诊断中极具临床价值。但纵隔镜检查作为一种侵入性操作,单独的操作程序会增加时间、费用和额外麻醉风险等。本次指南更新中将其应用的场景进行了些许修订。
对于多数I/II期肺癌患者,建议手术切除前行侵入性纵隔分期。
而对于行内镜超声(EBUS/EUS)分期的患者,如果无法现场快速细胞读片,可能就需要纵隔镜检查作为一个独立操作来评估。

诊断评估部分截图
病理学检查原则
病理检查是临床诊疗的金标准,对于肿瘤患者更是意义非凡。其中免疫组化检查的结果对肿瘤的诊断、治疗和预后分析尤为重要。
NSCLC按照组织病理学可分为腺癌、鳞状上皮细胞癌(鳞癌)、腺鳞癌、大细胞癌和肉瘤等。既往指南中强调,对于大细胞癌,即未分化的非小细胞癌(NSCC),缺乏小细胞癌、腺癌或鳞癌的细胞学、结构学和组织化学特征,诊断时需对切除的肿瘤进行彻底取样,而不能用非切除的标本或细胞学标本进行诊断。
本次指南更新,明确表明除了要对切除的肿瘤组织彻底取样外,还需进一步行免疫组化染色,以排除腺癌(TTF-1、napsin A)和鳞状细胞(p40、p63)癌。

病理学检查部分原则
随着科学技术的进步,针对肿瘤的研究越来越深入,诊断、治疗手段也越来越多元化,尤其是NSCLC的小分子靶向、免疫等治疗方案不断取得突破性的进展,使得NSCLC在精准治疗的道路上走在前列,其指南中推荐条目的适用场景也越来越精细化。肺癌诊疗领域的发展方兴未艾,期待未来捷报频传。
参考文献:
[1] Liu P, Wang Y, Li X. Targeting the untargetable KRAS in cancer therapy. Acta Pharm Sin B 2019;9:871-879.
[2] Janne PA, et al. Adagrasib in non-small-cell lung cancer harboring a KRAS G12C mutation. N Engl J Med 2022;387:120-131.
为了能更好地为大家提供更有趣、更有用、更有态度的内容,医学界肿瘤频道欢迎大家动动手指完成以下的调研,题量少、内容简单,只需十秒钟哦~
医生站网页版上线啦!
扫描下方二维码或点击阅读原文
| 留言与评论(共有 0 条评论) “” |