碳是6号元素的中文名称,根据它的拉丁文名称音译,我国先译作炭,这是古代就有的字,读tàn。名词,义为木材燃后之物。后来根据文化部门规定,把固体非金属元素的名称统一为石字偏旁,我国又为此专门新造了这个形声字,仍读此音。碳元素生成于恒星演化核燃烧阶段的氢燃烧和氦燃烧两种过程中;在地壳中,镭223、镭224和氡224,都可通过超非对称裂变产生碳14。宇宙丰度1.0101×107,居第4位; 地壳丰度480g/t,居第15位。在化学元素周期表中,碳属于p区ⅣA族第二周期的稳定性非金属固体元素。碳在远古时代就被人们发现了。古代的中国人还曾利用它和硫、硝石参与了火药的重大发明,但是欧洲人最早并未把碳当作一种元素,而是看作一种纯粹的 “燃素”。直到1789年,法国化学家拉瓦锡才第一次明确指出碳是一种元素,并把它归属于能氧化和成酸的非金属物质。这是人类发现的第一种元素,拉瓦锡为其命名的拉丁文名称叫carbonium。本名来自英文carbon,意思是“煤炭”;并用拉丁文名称第一个字母的大写体作为它的元素符号———C。

2存在形式
碳属于亲氧元素,在自然界里呈单质与化合物两种形式存在。单质主要存在于无定形碳、石墨和金刚石中;化合物分为两大类,一类以有机物形式主要存在于煤、石油、沥青、天然气、可燃冰和一切生物体中,另一类以无机物形式主要存在于石灰岩、大理岩、方解石、白云石、毒重石、菱镁矿、菱锰矿、菱铁矿、菱锌矿、白铅矿、碳酸锶矿、油母页岩和大气层的二氧化碳中。我国不仅有1.3万亿吨的煤储量,而且拥有质量最好的产自宁夏汝其沟的无烟煤。它具有特低硫、特低磷、特低灰,最高发热量的显著特点,1t煤可发出35.59GJ(850万千卡)的热量碳有,却仅产生种天然同位素1kg的煤渣名称。 符号及所占百分率分别是 碳 12C)占98.89%,
3 , 、 : 12(碳13(13C)占1.11%,碳14(14C)仅占万亿分之一。其中碳14为放射性同位素,仅痕量存在。另外还有12种人造放射性同位素,质量数为8~11和15~22。
碳的同素异形体有石墨、金刚石、无定形碳、球碳和单层碳纳米管。其中球碳又称富勒烯,都是偶数分子,包括C44、C50、C60、C70、C74、C80、C84、C120等;而无定形碳又细分为炭黑、木炭、焦炭、骨炭与活性炭。在世界上,石墨的主要产地在中国、西伯利亚和朝鲜半岛,天然金刚石的三大产地是扎伊尔、俄罗斯和南非。
3 物理性质
子量12.0807碳的原子半径,原子体积(共价半径5.30cm)773pm,离子电阻率半径15pm(+4)、260密度pm(-4);3原, 硬度为1°;比热容为711J/(kg·K/)mol,熔点为; 3550℃1375.0,μ沸点为Ω/cm4827℃; 2.267。 g/cm
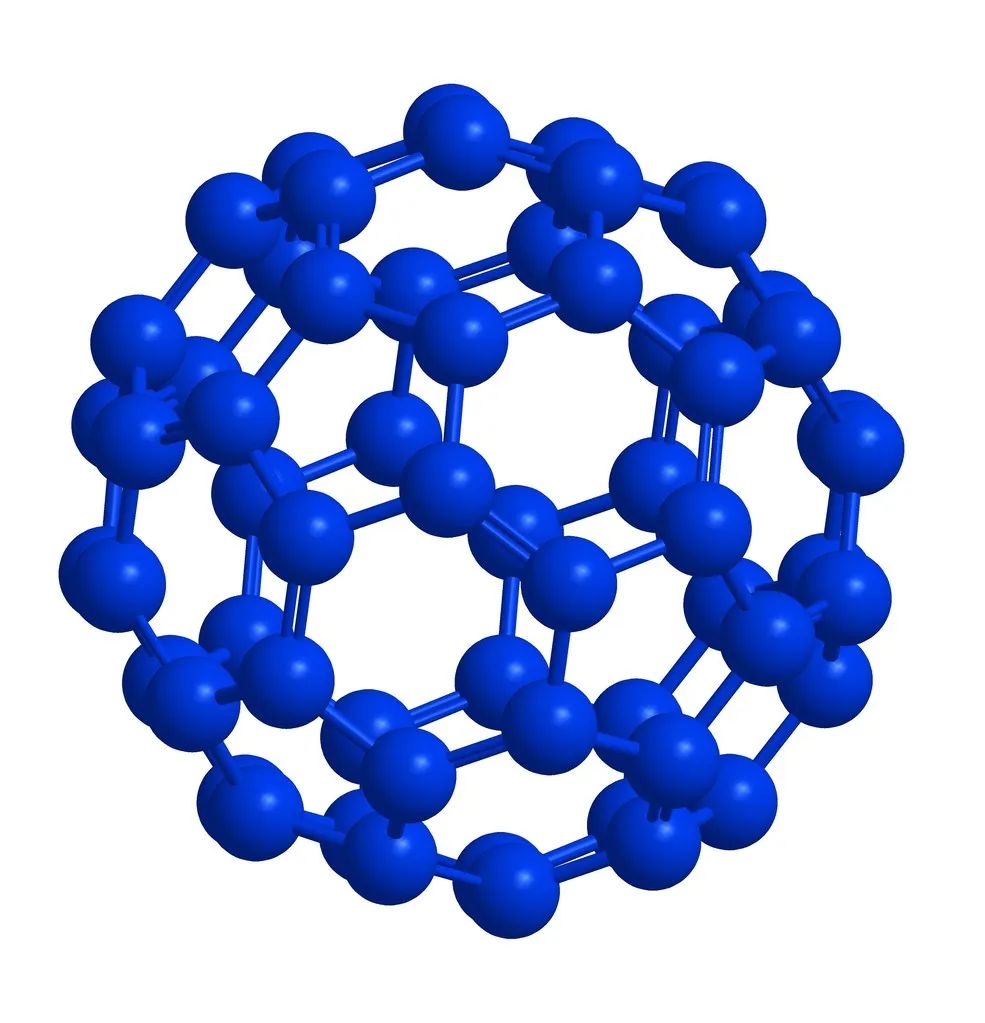
碳的各种同素异形体中,金刚石为网状结构的原子晶体,石墨为细鳞片形层状结构晶体单层和多层之分,碳纳米管为同心螺旋圆柱体结构,又有管端的开口和封口之别,;直径约富勒烯则是由几十个至几百个碳1nm,长可达1μm,既有原子组成的分子晶体空心球结构;无定形碳没有固定的形状和周期性结构规律, 大部分都是由石墨层状结构的分子碎片无规则地堆在一起形成的固体。金刚石无色,是绝缘体;硬度10级,虽为元素单质之最,可是在阳光下,若把它放在一个密闭的玻璃器皿内,一经聚光镜聚焦后发出的强光照射,当温度升高到900℃以上时,便能化作一缕青烟———无色的二氧化碳气体而消失。虽不导电,热导率却是金属铜的6倍。石墨黑色,晶体很软,是导电体,而且导电性能与其结构关系极大,石墨六元环所在平面的电导率是垂直方向的5000倍;导热性不仅高于其他非金属,甚至比某些金属还高。将金刚石隔绝空气加热,可以转化为石墨;在超高温和超高压条件下,也可将石墨变成金刚石。单层纳米管具有金属导电性或半导体性能分散在大气中的紫红色。,C球碳在固体时均呈黑色70为酒红色CO,,给太阳的短波辐射大开绿灯C76为黄绿色,但在液体时则因分子不同颜色各异……球碳C60分子在,使之畅通无阻地去加热地面-245℃以下具有超导性:比如C60为。,2
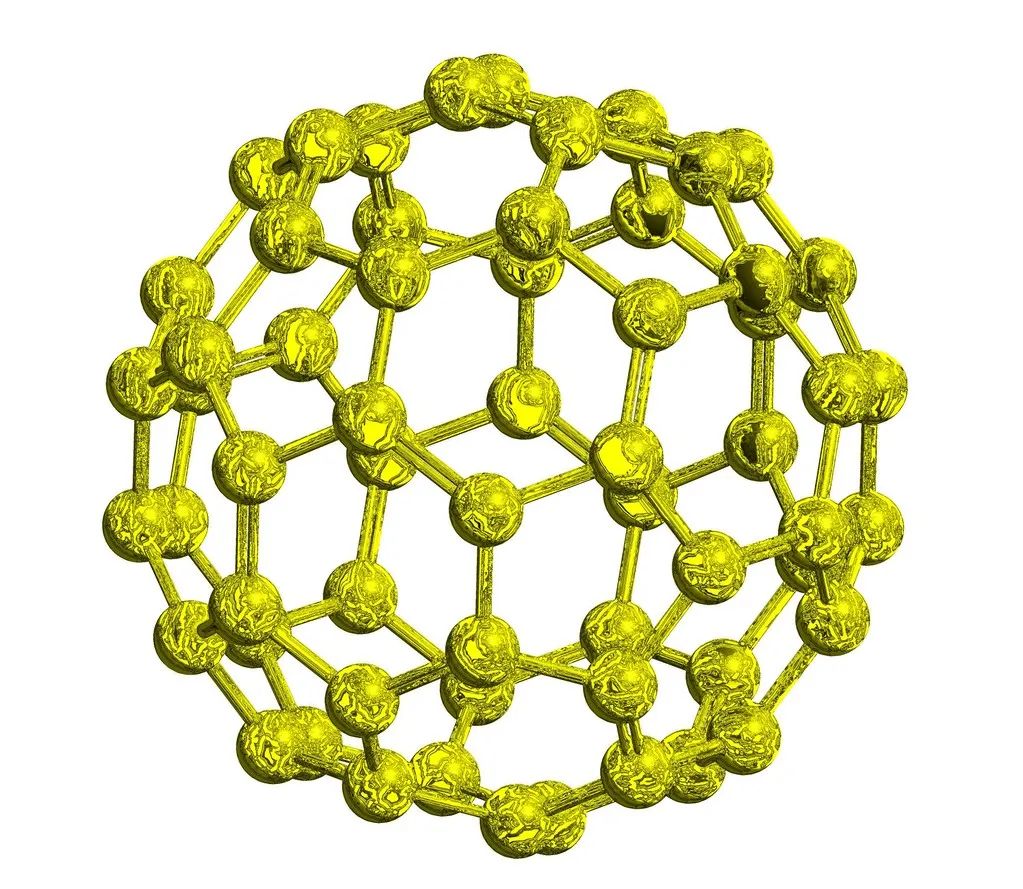
给各种生物带来温暖和能量;但它却禁止地面升温后发出的长波辐射通行,因而形成了大气对流层的温室效应,为地球生命的繁衍昌盛,创造了比较优越的条件。利用钠作还原剂,在400℃和800个大气压的条件下,二氧化碳在12个小时内, 就有7.3%变成石墨,8.9%变成金刚石。
4 化学性质
碳的价电子构型2s22p2,电负性2.5,第一电子亲和能122.555kJ/mol,第一电离能1086kJ/mol,标准电极势-0.200V;氧化数+4、-4、+2,常见化合价+4、-4。
碳在常温下的化学性质并不活泼,也不溶于水,但其化学活泼性能随温度的增加而迅速地大幅度提高,特别是气态时更加活泼。它不仅自相结合的能力很强, 既可形成单键和双键,又可形成叁键,既可连接成链和环,又可连接成网;而且与其他元素的原子,有的也可以形成单键、双键和叁键,并因可采用多种杂化轨道,既可形成直线形和正四面体,又可形成平面三角形。它与s区金属ⅢA族金属,可形成离子型碳化物;与跟自己电负性相同和相近的元素,能以共价键形成原子型碳化物;与d区过渡金属,多数以充填金属晶体晶格间隙的方式形成金属型碳化物;仅参与形成的有机化合物就高达1000多万种。
碳是酸性元素,溶于一般的碱,不溶于强碱,也不溶于稀酸和有机溶剂,但石墨却能与硝酸和高氯酸反应,也溶于某些熔融的金属中。高价氧化物为弱酸性, 溶于水生成碳酸。
碳的化合物类型最多,在无机化合物中,主要包括碳化物、氧化物、碳酸盐; 在有机化合物中,主要包括碳氢化合物以及糖、醇、醛、酯、醚、酮、酚、烯、
(葡萄糖腈等C6H在核反应方面。6)常、(C氰见H化[(OCN合,)物)2放射性同位素碳有]、:二氧化碳甲烷 (CH(CO144)、在放出)、乙碳酸炔β、-(C(射线后衰变成氮镁2HH、2CO2氧等元素的合成)、3)乙、碳酸钙醇 (14C2。H(CaCO6;而且碳还O在星际)、3)苯、
6 12 6 等。 2
在恒星演化的碳燃烧过程中,分别参与了钠、氖
气体里因被高能质子和高能α粒子猛烈撞击,分别裂解成了氦3、氦4、锂6、锂 7、铍9和硼10。碳12在人造85号元素砹、87号元素钫、98号元素锎和99号元核辐射衰变为其他元素素锿时,都充当过“炮弹。”它们的半衰期范围的角色。而被人造出的,从8C12的2种放射性同位素zs(仄秒,仄为,10都可通过-21的数量级,即10万亿亿分之一)到11C的20.334min。

5 主要用途
①金刚石因高熔点和高硬度身无弃物,透明者加工成昂贵的首饰和装饰品, 不透明者制成钻头和切割工具,二者加工时的粉末作研磨材料。
②普通石墨用来制造坩埚、电极、电刷、干电池、冷凝器、高温热电偶、润滑剂、颜料和铅笔芯;高纯度的石墨用作核反应堆的中子减速剂、防射线材料和火箭发动机喷嘴,也用于宇宙飞船和导弹部件;石墨粉涂在军用飞机表层,能将不同频率的微波能量转化为机械能、电能或热能,从而变成隐身飞机,使敌人的雷达变成“瞎子”;石墨炸弹不仅可破坏敌方防空和发电设备,而且对停在跑道上的飞机、发电厂的电网和电子设备,都能造成十分严重的破坏。
③半衰期5730年的碳14,在死亡后的生物体中只减不增,利用它在生物遗体和化石中的残留量及其所占比例的变化,可估算出该生物存活的年代,被誉为
“考古的时钟”。
④石油是碳化合物的仓库,可提炼出1000多种产品,比如石油气、汽油、煤油、柴油、润滑油、溶剂油、凡士林、重油、石蜡、沥青、乙烯等;煤炭也不仅
仅用作燃料,还可制造出许多化工产品。
⑤天然气除直接作为工业和民用燃料,其主要成分甲烷还可提取氢气,制造化工原料氯仿、乙炔和四氯化碳;其他成分乙烷、丙烷、丁烷,均是很好的化工原料。
⑥固体二氧化碳用作制冷剂、食品保鲜剂,也用于人工降雨和低温实验室; 气体二氧化碳既可作工业原料、温室肥料、灭火材料,又可加入啤酒和汽水,还可用作分子气体激光器的材料;在石油开采中,与水一起注入井内,既可提高采油率,又能用作洗井剂。而其最大贡献则是源源不断地供给绿色植物在光合作用中制造有机物质所需的大量原材料。
⑦碳纤维强度大、质量轻、耐高温、抗疲劳、抗腐蚀,常用于制造飞机、汽车部件,火箭、导弹的发动机和推进器,也用来制造撑杆、钓鱼竿、网球拍、高尔夫球杆等器材;活性炭多孔而坚硬,具有很强的吸附作用,可用来净化某些气体和液体,不仅用于防毒面具,还可以除去糖浆里的色素,除去工业用水和民用水中的有害物质和臭味,也用来防治肠道疾病。
⑧具有中空结构的碳纳米管,可作为高效储氢器,它的储氢密度甚至比液态氢和固态氢还高,而且使用氢时,稍加热就可释放出来;利用碳纳米管的超细性, 还可以首先灌入其他物质,然后
| 留言与评论(共有 0 条评论) “” |