*仅供医学专业人士阅读参考

2022年6月3日,备受关注的美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会在芝加哥以线上、线下会议的形式正式召开。针对mHSPC领域的几个问题:寡转移HSPC靶向转移灶长期结局如何,中期临床终点能否替代远期OS,创新药物早期强化治疗的真实世界疗效如何,本文精选几篇报道,邀请复旦大学附属肿瘤医院的朱耀教授分析点评,与读者共飨。
2022 ASCO Abs 5025#
寡转移性去势敏感性前列腺癌转移灶靶向治疗的长期结局和预测因子
“寡转移”的概念于20世纪90年代中期被首次提出,定义为局限性疾病与广泛转移的中间阶段,转移灶数目有限。已有前瞻性研究表明,针对寡转移性激素敏感性前列腺癌(omHSPC)的转移灶靶向治疗(Metastasis directed therapy,MDT)与患者的生存改善显著相关。本次会议上展示了两项针对omHSPC患者MDT治疗的随机对照试验(STOMP和ORIOLE)长期随访的汇总分析[1],同时评估了易感基因突变特征对MDT治疗疗效的预测能力。
研究入组STOMP(N=62)和ORIOLE(N=54)中随机接受单独MDT放疗或仅观察的omHSPC(<3个病灶)患者。主要终点为PFS[定义为PSA或影像学进展的时间、或开始雄激素剥夺治疗(ADT)的时间,或至死亡的时间,以先发生者计算],次要终点为rPFS(定义为至影像学进展或死亡时间)。同时,本研究通过下一代测序(NGS)来检测易感基因(包含ATM、BRCA1/2、Rb1或 TP53致病突变)与MDT疗效之间的相关性。
中位随访52.5个月合并分析显示,与观察组相比,MDT组的中位PFS显著延长[中位PFS 11.9 vs 5.9个月,HR 0.44(95% CI,0.29 – 0.66),p <0.001]。另外,短期观测指标亦能观察到两组治疗差异,MDT组中有84%的患者PSA降低,而观察组仅41%。
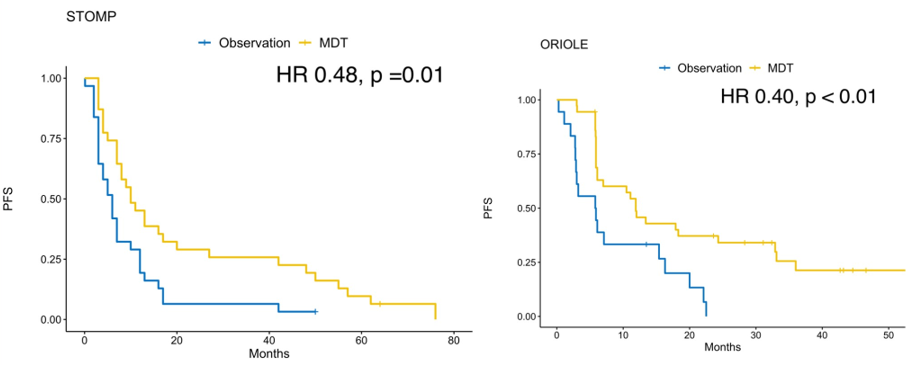
图1 STOMP和ORIOLE研究:不同治疗方案的PFS
两项研究中易感基因突变的发生率为24.3%。易感基因突变阴性患者的中位PFS长于突变阳性患者(中位11.9 vs 5.9 个月,HR 1.74,p=0.06)。易感基因突变阴性患者的中位rPFS显著长于突变阳性患者(中位22.6 vs 10.0个月,HR 2.62,p<0.01)。易感基因突变可作为PFS和rPFS的预后预测因素。
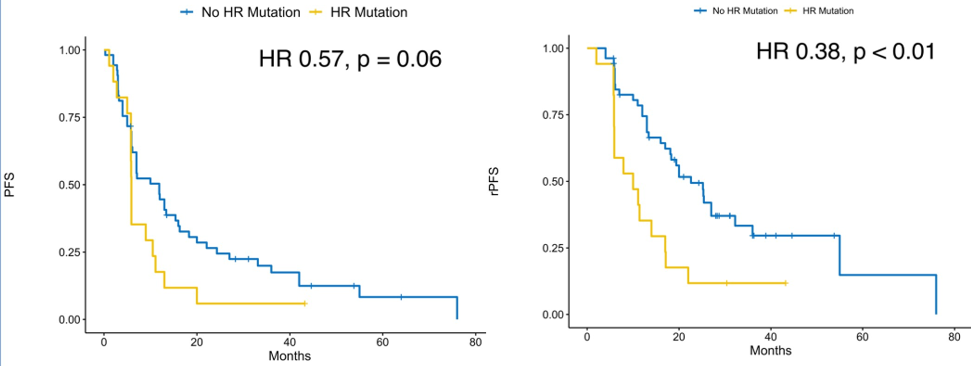
图2 STOMP和ORIOLE研究:不同易感基因突变状态的PFS
分层分析显示,易感基因突变阴性且接受MDT治疗的患者PFS最长,达13.4个月;而易感基因突变阳性但未接受MDT治疗的患者PFS最短,仅2.8个月。研究亦发现,易感基因突变阳性患者从转移灶靶向治疗的获益相对较大(易感基因突变阳性组:HR 0.05,p<0.01;易感基因突变阴性组:HR 0.42,p=0.01;交互检验p=0.12),这表明易感基因突变状态可以为转移灶靶向治疗筛选优势人群。
专家点评
omHSPC是前列腺癌进展中的过渡阶段,国内外指南推荐方案包括新型内分泌药物阿帕他胺在内的系统治疗、原发灶局部放疗联合系统治疗。近几年亦有学者研究omHSPC接受转移灶放疗和原发灶手术治疗的疗效和安全性。复旦大学附属肿瘤医院研究显示原发灶手术治疗较ADT单药治疗有更好的rPFS和PSA-PFS,但尚需进一步的随访验证长期获益。本文合并分析两项转移灶靶向放疗研究的长期随访结果,显示转移灶靶向放疗优于仅观察且可以持续获益。易感基因突变阳性患者进展更快,且可能从转移灶靶向治疗获益更多,提示易感基因突变阳性omHSPC患者早期接受更积极的治疗,获益更大。
2022 ASCO Abs 5006#,Abs 5039#
mHSPC中期临床终点能否“替代”为传统疗效终点?
总生存期(OS)虽是临床疗效的金标准,但也存在样本量大、随访期长、费用高,易受其他药物干扰等问题。临床或研究亦在探索其替代终点,病理完全缓解(pCR)、无病生存期(DFS)、无事件生存率(EFS)和疾病控制率(DCR)等,都可归为之列。替代终点的日益发展也带来了许多问题:替代终点如何选择?替代终点能否代替传统终点呢?
本次会议上的一项STOPCAP M1 Collaboration研究(Abs 5006#)[2]评估了 rPFS和cPFS作为潜在中期临床终点(ICEs)的替代性。rPFS定义为从随机化到影像学进展(根据方案定义)或任何原因导致的死亡(以先发生者为准)的时间;cPFS定义为从随机化到影像学进展、症状、开始新治疗或死亡日期的时间,以先发生者为准。入选mHSPC治疗方案(ADT或ADT+多西他赛)的随机试验,获得了个体患者数据(IPD),通过二阶段元分析验证模型,计算了替代阈值效应 (STE),估计对生存期(OS)的非零效应所需的最小ICE治疗效应。
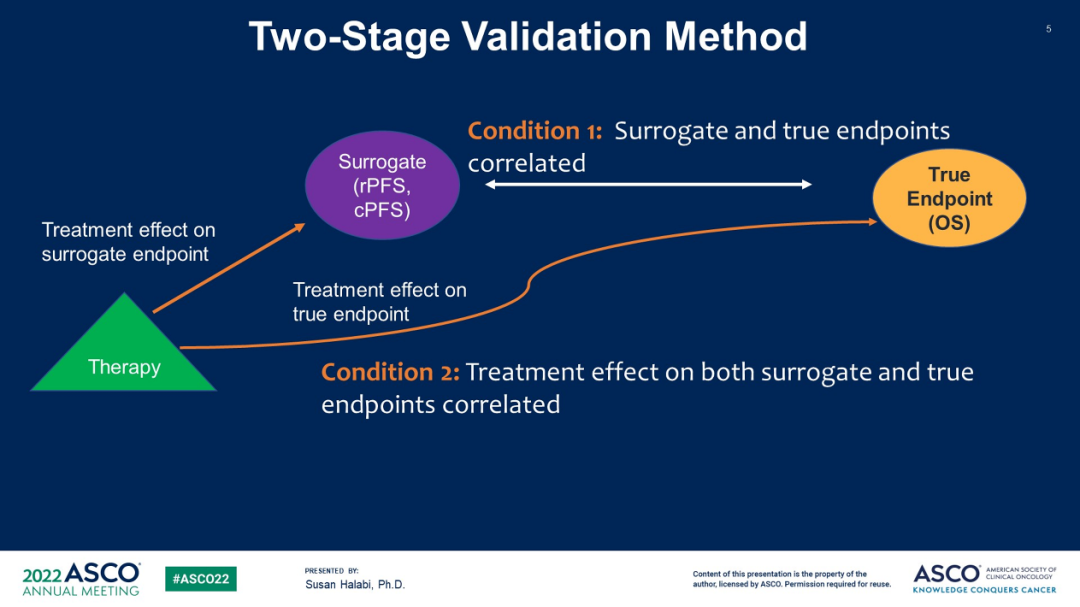
图3 研究设计
研究共纳入来自1994-2012年间的13项试验,涉及8592名患者的IPD被纳入分层分析。5377例死亡,其中3971例(74%)死于前列腺癌。中位年龄67岁,PS评分0占比68%,使用基于ADT方案的研究占比61%。存活患者的中位随访时间为75.6个月,中位OS、rPFS和cPFS分别为4.1、2.3和2.1年。
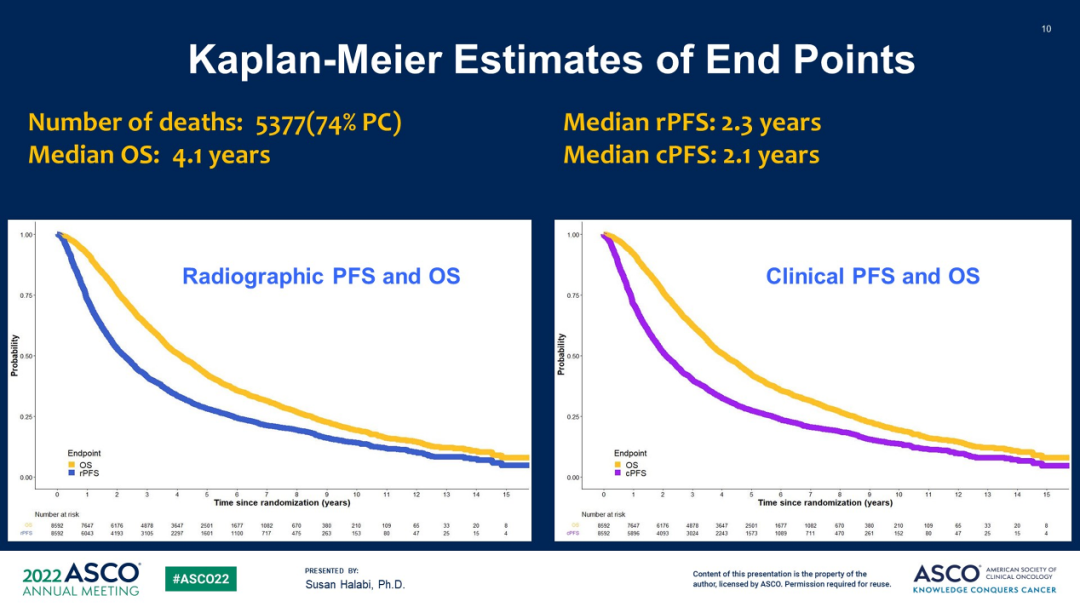
图4 OS、rPFS 和 cPFS
结果显示,rPFS的STE为0.83,cPFS的STE为0.84。
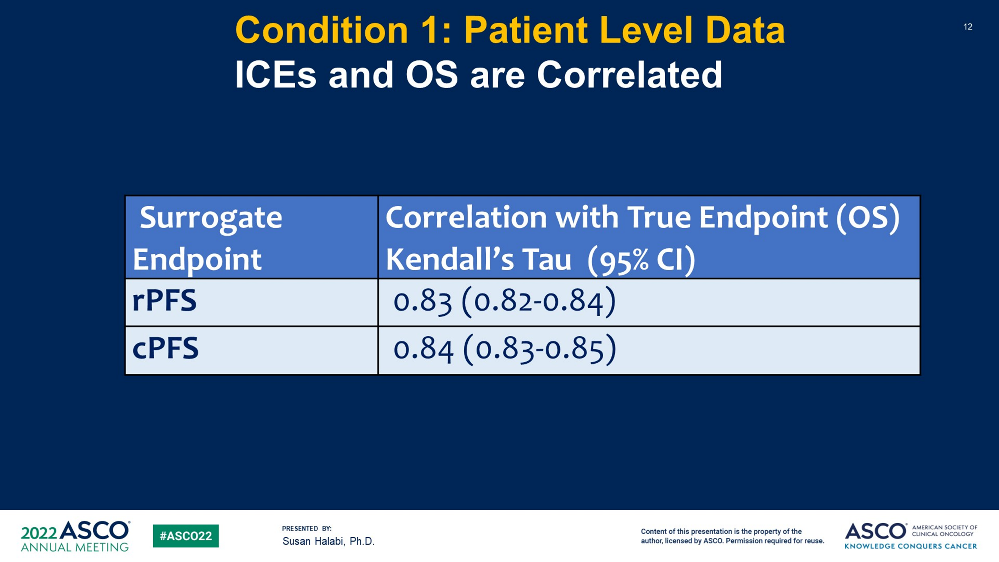
图5 ICEs和 OS的相关性
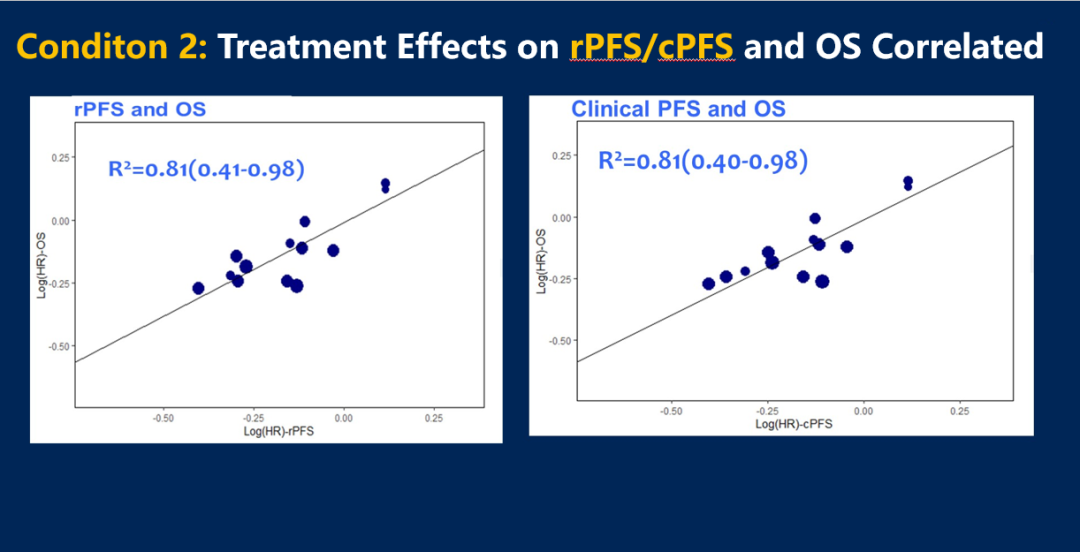
图6 疗效上rPFS或cPFS与OS的相关性
该研究表明,rPFS和cPFS似乎均可作为III期mHSPC研究中OS的有效替代终点。
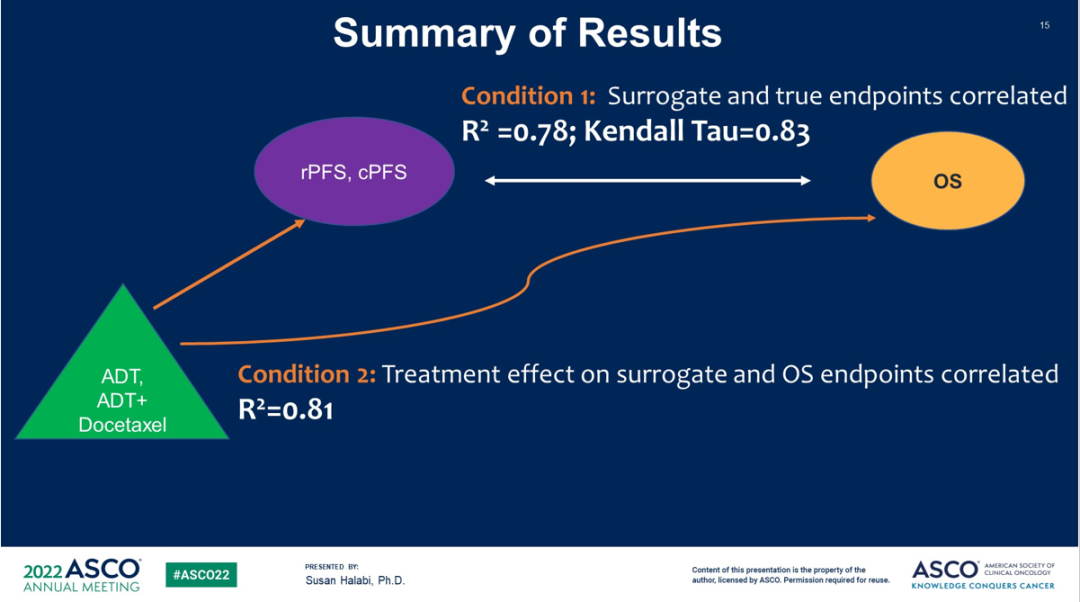
图7 研究结论
然而,另一项汇总荟萃分析(Abs 5039)[3]却得出了相反结论。该研究通过PubMed检索了共143项(n=75,601)报告OS和≥1个ICE[包括生化失败(BF)、临床失败(CF)、无生化失败生存期(BFS)、无进展生存期(PFS)、影像学±其他研究定义的终点(rPFS)]的晚期前列腺癌临床试验,发现无候选终点符合替代标准。BF(n=28,922)的R2为0.42(95%CI, 0.18-0.64),BFS(n=25,741)为0.57(95%CI,0.37-0.73), CF(n=22,616)为0.31(95%CI,0.0075-0.56),PFS(n=52,639)为0.50(95%CI,0.35-0.63),rPFS(n=52,548)为0.50(95%CI,0.35-0.63)。
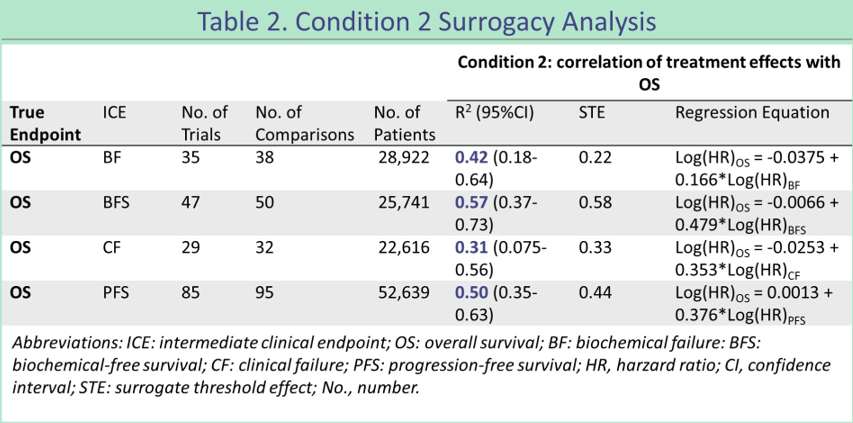
图8 替代标准分析
在去势敏感性或抵抗性或治疗类型预先设定的亚组中,BFS和PFS均不符合替代标准。在评估影像学定义的进展(排除或伴有临床进展)时,整个组和去势状态的 PFS 亦不符合替代标准。敏感性分析表明,所有候选终点的替代资格不会随着时间而改变。
该研究说明,常用的临床终点均不是OS的有效替代终点,未来还需要进一步探索构建复合终点。
专家点评
替代终点作为衡量临床结局、减少临床观察时间的有效指标,在前列腺癌新药开发和审评程序中的应用正变得日益广泛,但替代终点是否能完全“代替”传统OS终点,并未达成一致意见。未来,我们应对替代终点进行持续监测,挖掘其他替代终点比如PSA深度应答等以便更好地了解替代终点与临床结局指标之间的相关性。此外,真实世界证据也可作为补充,与替代终点指标相互印证,从而提高药物可及性。
2022 ASCO Abs e17052#
思考:药物研发进展对转移性前列腺癌生存预后的影响
在过去十年中,随着新型雄激素受体通路抑制剂[阿比特龙(2011)、恩扎卢胺 (2012)、阿帕他胺(2018)和镭223(2013)]在内的新疗法的批准,转移性前列腺癌(mPCa)患者的生存预后得到不断的改善。然而,在人群水平上的生存获益尚不清楚。本次会议发布的一项回顾性分析[4]旨在评估过去十年药物研发进展对新诊断mPCa患者生存的影响。
研究通过检索SEER 数据库并纳入2000 至 2018 年期间新发≥18 岁mPCa患者33,969 例。按照诊断年份,将患者分为两个治疗期:2000-2010 年[A 期,15,433(45.4%)]和 2011-2018 年[B 期,18,536(54.6%)]。 使用Kaplan-Meier 评估前列腺癌特异性生存期(pCS)和总生存期(OS);对数秩检验比较两时期之间的pCS和OS。进行单变量和多变量cox回归模型以确定pCS和OS的显著协变量。
结果显示,两时期的临床病理学和社会经济特征无显著差异。与时期A相比,时期B的中位pCS(36 vs 30个月,p < 0.001)和 OS(30 vs 25个月,p<0.001)更长。在 pCS 的多变量模型中,在时期 B确诊与前列腺癌死亡风险显著降低相关(HR:0.89,CI:0.85-0.94,p< 0.001)。年龄&80 岁(HR:1.6, p < 0.001)、PSA & 50 ng/mL(HR:1.3, p < 0.001)和低分化组织学(HR:2.0, p < 0.001)是pCS恶化的重要预测因子。西班牙裔(HR:0.94, p=0.02)和家庭收入中位数&75000 美元(HR:0.86,p=0.007)与更好的pCS相关。在OS的多变量模型中,在时期B确诊与全因死亡风险降低显著相关(HR:0.89,CI:0.85-0.93,p <0.001)。年龄&65 岁(HR:1.26, p < 0.001)、PSA&50 ng/mL(HR:1.30, p < 0.001)和低分化组织学(HR:1.6, p < 0.001)与较差的OS相关。西班牙裔(HR:0.94, p=0.01) 和家庭收入中位&75000 美元(HR:0.81, p < 0.001)与更好的OS相关。
综上,B期(2011-2018 年)新诊mPCa与更好的pCS和OS改善相关。然而,在这项基于人群的研究中观察到的全因死亡风险仅降低了11%,低于临床试验报告的20-38%。
专家点评
随着创新药物的上市,新型内分泌药物早期强化治疗显著改善了mPCa患者的总体生存获益。本项回顾性分析与之前报道的STAMEPEDE研究中阿比特龙组长期随访数据对应,经过中位随访73个月后,阿比特龙联合ADT较ADT组显著降低了死亡风险,提高5年生存率至60%,说明新型内分泌药物治疗前移,即诊断mHSPC时就使用新型内分泌治疗,相比ADT,患者的5年生存率得到大幅提高。然而,在降低全因死亡风险上,本研究却与既往临床试验存在较大的差异,这可能与创新药物可及性、医疗机构诊疗差异、患者经济状况等多种因素相关。
专家简介

朱耀 教授
主任医师,副教授,博士生导师
复旦大学附属肿瘤医院泌尿外科行政副主任
中国临床肿瘤学会前列腺癌专家委员会秘书长
上海市抗癌协会青年理事会副理事长
中国抗癌协会泌尿男生殖系肿瘤专委会精准学组副组长
2019年复旦大学青年五四奖章
2019年上海市卫健委青年五四奖章
2018年上海市“医苑新星”杰出青年医学人才
第七届复旦大学十大医务青年
第三批复旦大学卓学人才计划
入选2015年上海市青年科技启明星计划
担任Prostate Cancer and Prostatic Disease编委
以通讯作者在European Urology和Journal of Urology发表8篇论文,以第二完成人获得上海市科技进步奖一等奖
国家自然科学基金评审专家
参考文献:
[1].Deek MP et al. 2022 ASCO Abs 5025.
[2].Halabi S et al. 2022 ASCO Abs 5006.
[3].Gharzai LA et al. 2022 ASCO Abs 5039.
[4].Adekolujo OS et al. 2022 ASCO Abs e17052.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |