*仅供医学专业人士阅读参考


2022年ASCO年会于6月3日-7日在芝加哥以线上、线下会议的形式举行。会议期间发布了多项基因突变转移性去势抵抗性前列腺癌(mCRPC)相关重磅研究,本文主要分享3项研究,分别为MAGNITUDE研究中阿比特龙为基石方案治疗HRR基因突变患者的疗效、患者健康相关生活质量分析,以及中国前列腺癌患者HRR基因突变分析。并邀请西安交通大学第一附属医院泌尿外科李磊教授为大家进行深入解读。
MAGNITUDE研究:尼拉帕利(NIRA)与醋酸阿比特龙和泼尼松(AAP)联合治疗携带同源重组修复(HRR)基因突变的转移性去势抵抗性前列腺癌(mCRPC)患者的逐个基因分析[1](POSTER Bd#204)
MAGNITUDE研究已证实NIRA+AAP可显著改善BRCA1/2+亚组和所有HRR BM+患者的预后,但是目前尚缺乏支持PARPi用于治疗BRCA1/2+之外的其他HRR基因突变患者的数据。本研究评估了NIRA+AAP在携带单一HRR基因突变(BRCA1/2以外)mCRPC患者中的疗效。共纳入186例携带ATM、BRIP1、CDK12、CHEK2、FANCA、HDAC2或PALB2单一基因突变的患者,随机分配至NIRA + AAP组( n= 91)或PBO+AAP(n=95)。主要终点是盲法独立中心审查委员会(BICR)评估的影像学无进展生存期(rPFS)。次要终点为至细胞毒性化疗时间(TCC)、至症状进展时间(TSP)、总生存期(OS)。其他终点包括PSA进展时间(TPSA)和客观缓解率(ORR)(图1)。
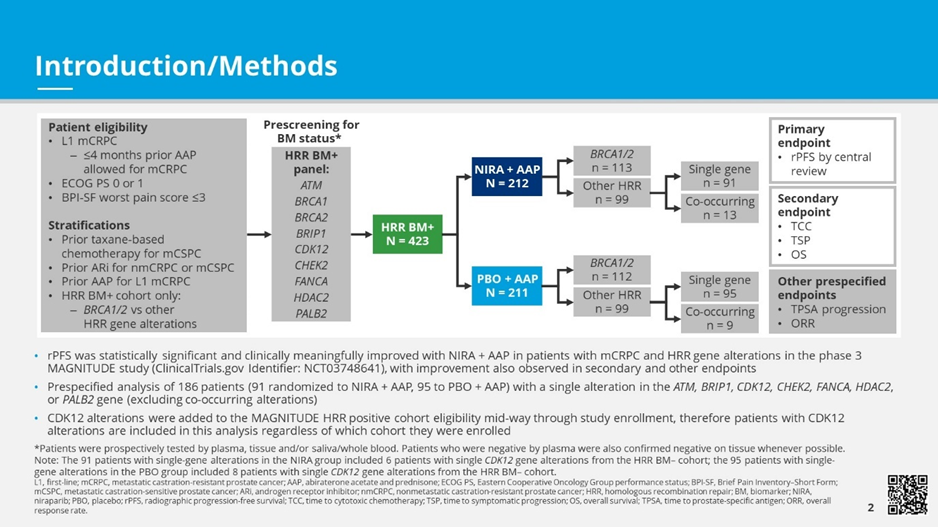
图1 研究设计
结果显示,PALB2或CHEK2、HDAC2基因突变的患者中,NIRA+AAP治疗在所有研究终点均有获益。ATM突变患者接受NIRA+AAP治疗后,在TCC、TSP、TPSA和ORR等方面观察到获益。CDK12突变的患者仅有TPSA和ORR获益。BRIP1突变患者似乎只有rPFS获益。进行基因功能分组之后,HRR-Fanconi 通路变异(BRIP1、FANCA 、PALB2)的患者及HRR相关变异(CHEK2 、HDAC2)的患者接受NIRA联合阿比特龙和泼尼松治疗也能获得所有研究终点的改善。(见表1)。
表1 MAGNITUDE研究的基因-疗效分析
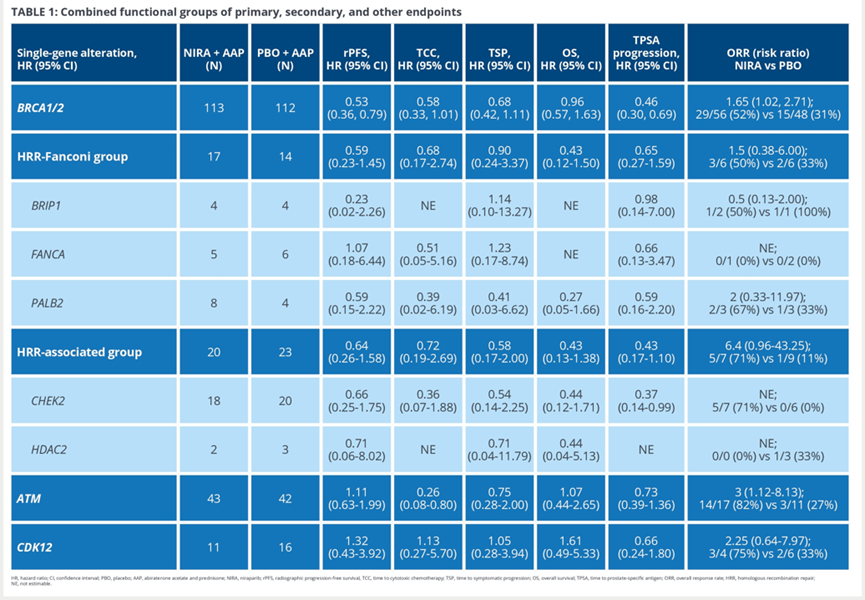
以上数据支持MAGNITUDE研究初步分析的结论,在BRCA1/2以外的其他HRR基因突变的患者中观察到了NIRA+AAP治疗的生存改善,NIRA 联合AAP在包括BRCA1/2突变的所有HRR基因突变患者中均有获益。
MAGNITUDE研究:尼拉帕利(NIRA)与醋酸阿比特龙和泼尼松(AAP)联合治疗携带同源重组修复(HRR)基因突变的转移性去势抵抗性前列腺癌(mCRPC)患者的健康相关生活质量(HRQoL)和疼痛分析[2](POSTER Bd#243)
MAGNITUDE既往研究结果证实NIRA + AAP可改善HRR突变mCRPC患者的生存获益,且不良反应可控。本次ASCO会议对MAGNITUDE研究中患者健康相关生活质量(HRQoL)和疼痛分析做了相关报道。
入组患者的体能状态评分(ECOG)≤1,简明疼痛量表评分 (BPI-SF)≤3。HRQoL评估包括总体生活质量(FACT-P)和BPI-SF。分析比较各治疗组基于基线的变化,以及两组间至疼痛强度恶化的时间(TTD)。NIRA+AAP组基线存在内脏转移、骨转移,以及EGOG PS为1分的患者比例高于PBO+AAP组。
结果表明,NIRA + AAP能够维持健康相关生活质量。FACT-P总评分、身体健康状况评分随时间的变化或组间比较都没有显著差异(图2)。与PBO + AAP组比较,NIRA + AAP组的疼痛强度TTD有延长趋势(11.1个月vs 10.1个月,HR=0.87)(图3)。
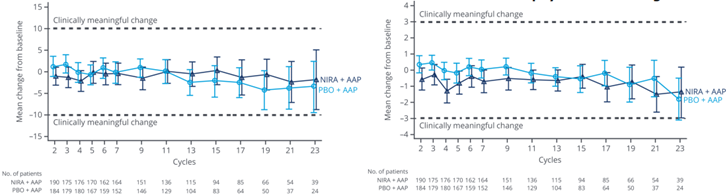
图2 FACT-P总评分基于基线随时间的变化(左)和FACT-P机体健康基于基线随时间的变化(右)
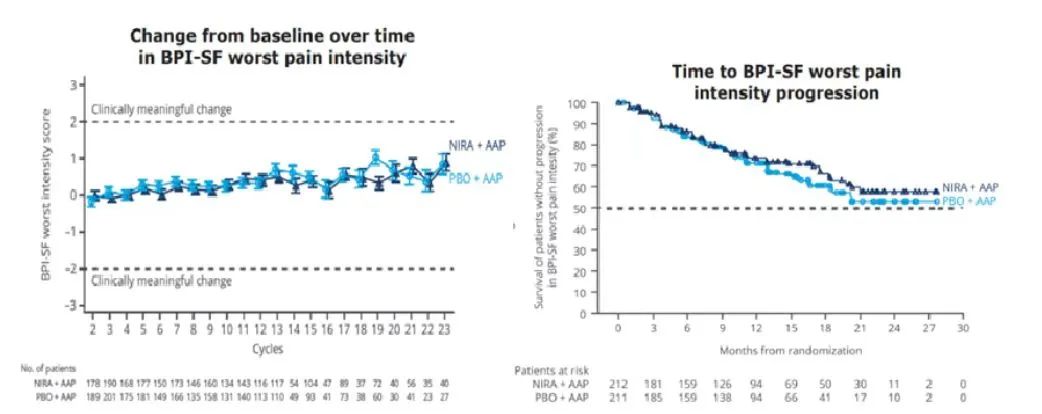
图3 BPI-SF疼痛强度随时间变化(左)和至疼痛强度恶化时间(右)
综上, 大多数患者在行NIRA联合AAP治疗,都能维持较低疼痛水平和良好的HRQoL,尽管接受NIRA +AAP治疗的患者在早期 FACT-P评估中报告了不良反应的加重,但症状通常是轻微的。该结果也进一步支持在HRR突变的mCRPC患者中使用NIRA + AAP治疗。
中国前列腺癌患者基因图谱和同源重组修复(HRR)基因突变分析[3](Abstract e17020)
HRR基因突变已被证明是PARP抑制剂(PARPi)治疗mCRPC的有效生物标志物,然而,中国前列腺癌患者基因组变异情况及HRR基因突变特征的流行病学资料尚不充足。国内这项研究利用733panel对250例前列腺癌患者的组织和血液样本进行NGS检测。HRR通路基因的体系或胚系改变,包括拷贝数目减少、CNV缺失(copy number variation,拷贝数变异)被定义为HRR突变阳性。
研究结果显示,中国前列腺癌患者高频体系突变基因包括 FOXA1(24.9%)、TP53(15.2%)和 MYC(13.6%),而高频胚系突变基因包括 DPYD(17.1%)、UGT1A1(13.2%)和 SLX4( 4.3%)。在HRR通路基因中,25.6%的患者携带HRR基因突变,突变频率最高的体系基因是 CDK12 (9.7%)、ATM (4.7%) 和 BRCA2 (3.9%),突变频率最高的胚系基因是BRCA2 (3.1%)、PALB2 (1.9%)和BRCA1 (1.6%)。45例有同源重组缺陷(HRD)评分的HRR 突变阳性病例中,大多数携带单一HRR 基因突变(CDK12为40.0%,ATM 或 BRCA2 为17.8%,BRCA1为11.1% ,PALB2 或 FANCA为2.2%),只有 8.9%的患者携带1种以上HRR基因突变。45例患者中检测到61个HRR基因突变,单碱基替换是最常见的HRR基因突变类型(47.5%),而CNV缺失 (14.8%)仅在体细胞样本中检测到。HRR突变组的HRD评分显著高于野生组(HRD评分中位数,突变型vs野生型= 23.5 vs 19.0, P= 0.0097),且CNV缺失与其他突变类型的HRD评分差异无统计学意义。HRR突变组的肿瘤突变负荷(TMB)有高于野生组的趋势(TMB中位数,突变型vs野生型=4.5 vs 2.8Muts/Mb,P=0.5)。
该研究显示了中国前列腺癌患者HRR基因突变特征,并表明HRR基因突变与较高的HRD评分相关。这些数据为PARPi个性化治疗的临床管理提供了进一步的证据。
专家点评
mCRPC是前列腺癌的终末阶段,一线治疗方案的选择会直接影响患者的生存获益。尽管化疗药物和新型内分泌药物的推陈出新在很大程度上重塑了前列腺癌的治疗格局,但整体获益依然十分有限,而随着医疗技术的发展和对分子生物学的深入探索,精准化、个体化诊疗有望带来新的突破。
细胞内存在功能完善的多种DNA损伤检测、识别和修复系统。DNA修复是机体维持DNA结构完整性与稳定性,保证生命延续和物种稳定的重要环节。mCRPC具有高度分子异质性,约1/4的患者存在DNA损伤修复相关基因突变,正常情况下肿瘤细胞依赖DNA单链修复(包括PARP)和DNA双链修复(包括同源重组修复)等途径来保证其细胞基因组的稳定。若同源重组修复功能缺陷(HRD),在此基础上使用PARP抑制剂抑制PARP功能,就能通过“合成致死”效应引起肿瘤细胞的凋亡[4]。HRR基因是同源重组修复通路及其上下游中对DNA双链断裂修复起到重要作用的一组基因,HRR相关基因发生突变或其他改变,都会引起HRD,除了BRCA1/2之外,同源重组修复通路还包括上下游调控的众多其他基因,它们也在DNA双链断裂的修复中起到重要作用,目前公认的HRR相关基因还有ATM、BARD1、BRIP1、CDK12、CHEK1/2、FANCL等[5]。
MAGNITUDE前期研究结果[6]已经证实,在BRCA1/2突变的mCRPC患者中,尼拉帕利 +阿比特龙方案可显著延长患者rPFS。除了BRCA1/2之外,其他HRR基因突变的患者是否能从PARP抑制剂联合阿比特龙治疗中获益?本次ASCO会议报道了MAGNITUDE研究中除了BRCA1/2基因之外其他HRR基因突变患者对尼拉帕利+阿比特龙的疗效应答情况,研究结果显示在ATM、BRIP1、CDK12、CHEK2、FANCA、HDAC2或PALB2等HRR基因突变的患者中均观察到了NIRA +AAP治疗的生存改善。除了延长生存之外,改善mCRPC患者的生活质量也同样重要,本次大会还报道了MAGNITUDE研究中患者HRQoL数据,结果显示,NIRA +AAP治疗后患者能维持良好的生活质量。而大会中公布的这项关于中国前列腺癌患者HRR基因突变特征的研究结果,则有助于指导临床合理选择PARP抑制剂,改善前列腺癌患者的治疗结局,为更多患者争取精准靶向维持治疗机会。
纵观mCRPC的治疗,对雄激素通路的抑制仍然是基石,PROfound[7]研究开启了前列腺癌精准治疗的序幕,而MAGNITUDE研究和PROpel[8]研究中PARP抑制剂联合阿比特龙治疗的获益,则为前列腺癌精准治疗提供了新思路。事实上,DNA损伤修复通路和AR通路之间可以相互影响,临床前研究提示,PARPi和阿比特龙具有协同抗肿瘤作用,一方面,PARP抑制可以协助阿比特龙阻断AR通路[9-10];另一方面,AR通路抑制剂下调DNA损伤修复通路(DDR)基因的转录[10-11],联合治疗可增强“合成致死”效应。除了PARP抑制剂之外, SBRT联合阿比特龙、帕博利珠单抗联合阿比特龙、Capivasertib联合阿比特龙等治疗mCRPC的临床研究也在如火如荼的开展,希望以阿比特龙为基石的靶向联合治疗能更好的解决晚期前列腺癌患者的治疗困境。
专家简介

李磊 教授
教授,主任医师,研究员,博士生导师;
西安交通大学第一附属医院泌尿外科主任,学科带头人;
陕西省医学会泌尿外科学会副主委;
中华医学会青委会转化医学学组组长;
中国研究型医院学会泌尿外科分会青委会副主委等;
主要从事前列腺癌、膀胱癌及肾癌等泌尿系肿瘤的基础和临床工作,是西安交通大学第一附属泌尿外科前列腺癌亚专业带头人,擅长泌尿系统尤其是下尿路达芬奇机器人辅助手术治疗;
获得国家科技部 “973”和“863”项目子课题各一项,科技部重点研发计划子课题1项,独立主持国家自然科学基金青年及面上项目4项,参与国家自然科学基金重点及面上项 目5项,累计发表SCI收录论文62篇。
参考文献:
[1]2022 ASCO POSTER Bd#204.
[2]2022 ASCO POSTER Bd#243.
[3]J Clin Oncol 40, 2022 (suppl 16; abstr e17020).
[4]Teyssonneau D, et al. Prostate cancer and PARP inhibitors: progress and challenges.J Hematol Oncol. 2021.
[5]Abida W, et al. Prospective genomic profling of prostate cancer across disease states reveals germline and somatic alterations that may afect clinical decision making. JCO Precis Oncol. 2017.
[6]J Clin Oncol 40, 2022 (suppl 6; abstr 12).
[7]Maha Hussain,et al. N Engl J Med. 2020 Dec 10;383(24):2345-2357.
[8]J Clin Oncol 40, 2022 (suppl 6; abstr 11).
[9]Polkinghorn WR et al. Cancer discov, 2013;3(11); 1245–53.
[10]Schiewer MJ et al. Cancer Discov 2012; 2: 1134–49.
[11]Asim M et al. Nat Commun 2017; 8: 374.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |