*仅供医学专业人士阅读参考
基于机制、立足循证,推动T-DXd在HER2阳性晚期胃癌领域的深入研究。从治疗战线前移,到联合方案探索,多维度拓宽获益人群,以期为更多患者提供治疗选择。
HER2是胃癌的重要靶点之一,在胃癌中过表达或基因扩增的比例约为12%-20%[1]。曲妥珠单抗联合治疗奠定了HER2阳性晚期胃癌的一线治疗地位,Keynote-811研究[2]也进一步证实了抗HER2治疗的重要性,但此类患者抗HER2治疗的选择仍然有限,亟需进一步的临床获益。新型抗体药物偶联物(ADC)的出现为HER2阳性晚期胃癌患者提供了新的治疗选择。目前,国内外均有ADC获批适应症并得到指南推荐。
当下,胃癌领域以HER2为靶点的ADC主要包括T-DXd、RC48及ARX788等。其中,T-DXd(DS-8201,Enhertu)是国际上首个被批准治疗HER2阳性胃癌的ADC药物,已分别获得日本(MHLW)和美国(FDA)的批准用于晚期HER2阳性胃癌患者的后线治疗。T-DXd在ADC药物中的突破性疗效及良好的安全性与其独特的药物设计和作用机制密不可分。
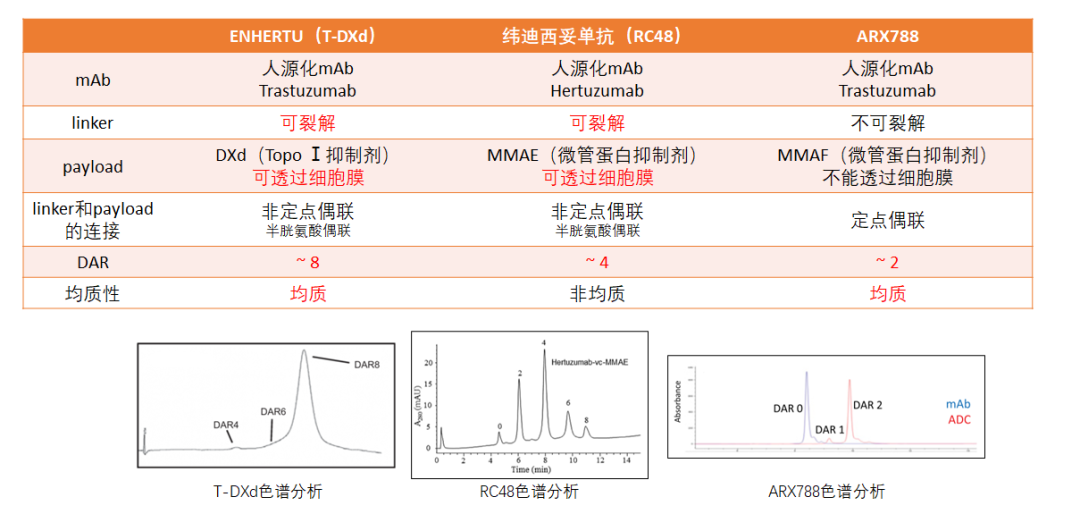
图1. 胃癌领域抗HER2-ADC结构对比[3-7]
(注:各药物的均质性问题见色谱分析图)
独树一帜!T-DXd凭借精巧设计与独特机制,在ADC赛道中异军突起
ADC由单克隆抗体和强杀伤的细胞毒性载药通过连接子共价偶联而成,当抗体与靶细胞的表面抗原结合后,ADC被内吞进入肿瘤细胞内部,然后在溶酶体中发生降解,释放出高活性载药,破坏DNA或阻止肿瘤细胞分裂,起到肿瘤杀伤作用[8]。
ADC结合了靶向性、选择性强的抗体和高抗肿瘤活性细胞毒性药物的双重优势,能高效精准杀伤肿瘤,大大提高了抗肿瘤治疗的获益风险比。随着研发水平不断提高,目前ADC已经发展至第三代,其中最引人注目的药物当属T-DXd。
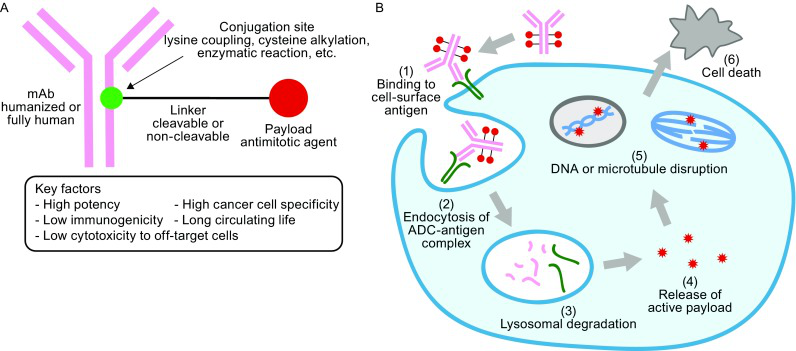
图2. ADC药物的结构和作用机制示意图[8]
T-DXd由靶向HER2的人源化单克隆抗体曲妥珠单抗通过酶切肽连接子与新型DNA拓扑异构酶Ⅰ抑制剂偶联而成。T-DXd采用前沿设计理念,具有多个差异化亮点:
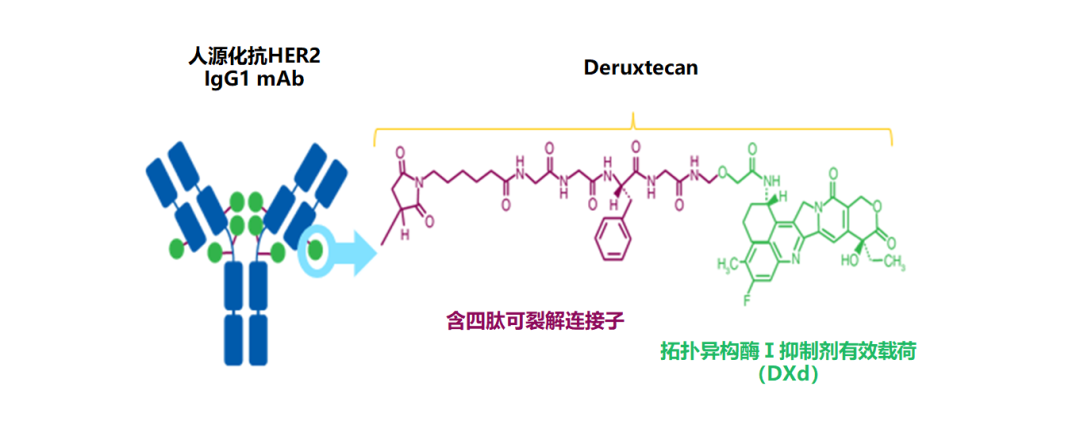
图3. T-DXd的化合物结构图[6]
可裂解连接子结构优化,达到疗效最大化的同时保证系统安全性
T-DXd使用基于GGFG四肽序列的可裂解连接子,被靶细胞内吞后,由肿瘤细胞中高表达的溶酶体蛋白酶特异性识别并切割,实现载药的高效释放;选择半胱氨酸偶联方式,控制单个抗体载药量的同时保证药物均质性,使T-DXd的药物抗体比(DAR)达到8,超越现有ADC药物,大大增强抗肿瘤效力;反相色谱分析显示,T-DXd的DAR分布均一,有助于向靶细胞输送更多药物,从而发挥更强的肿瘤杀伤效应[9-11]。
理论上药物浓度越高,抗肿瘤效应越强,由此推断DAR应该越高越好。但DAR过高可能造成ADC稳定性不佳、脱靶毒性较高等问题,因此既往观念认为DAR为2-4的ADC的稳定性和安全性更具优势[12]。然而ARX788的DAR仅仅为2,却具有较为明显的眼毒性[13] 。T-DXd的合成运用了经过优化的连接子技术,并不存上述问题。并且与传统氨基苄基(PAb)连接子(如SYD985和RC48)相比,T-DXd的四肽连接子疏水性更低,即便是偶联8个载药也不容易发生聚集,保证体内循环稳定的同时又保障足够的有效胞内药物浓度[14]。并且,尽管连接子可裂解,但其在血液循环中具有较高的稳定性,载药DXd的脱落率极低,能较大程度减少系统性脱靶效应。有研究表明,21天血浆中DXd的释放率仅为1.2%-3.9%,与之相比,T-DM1在4天时释放率高达18.4%[9]。不仅如此,游离DXd的系统半衰期仅1.37小时[15],能够更快排出体外,快速降低血药浓度,有助于进一步降低非靶点毒性。
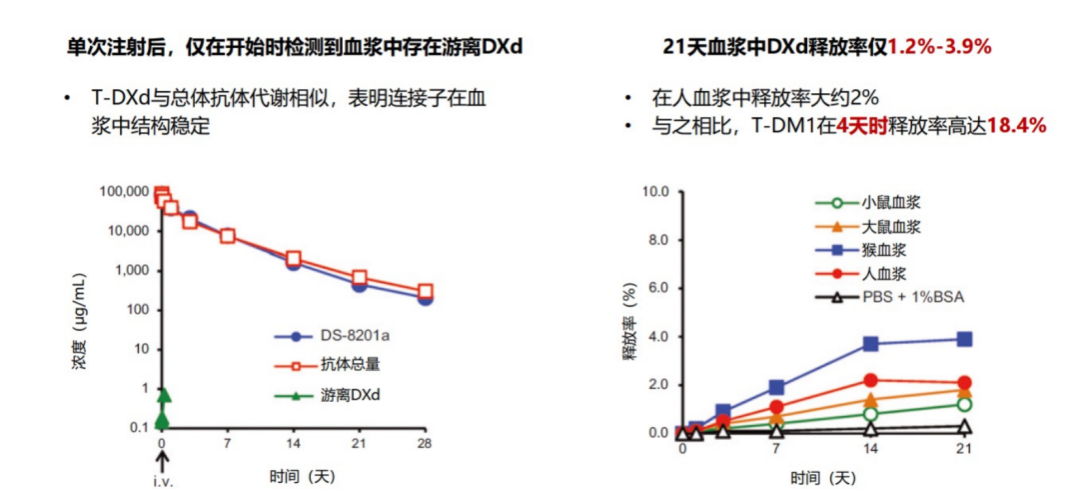
图4. T-DXd的连接子在血浆中稳定,载药脱落率极低[9]
全新机制的高活性载药,避免耐药且抗肿瘤活性强大
载药是ADC的核心构成,可直接或通过旁观者效应杀伤肿瘤细胞。T-DXd的载药是新型拓扑异构酶Ⅰ抑制剂DXd,主要具有以下特性:一方面,DXd与常用化疗药物作用机制不同,能避免与既往治疗出现交叉耐药;其次,DXd具有强效的抗肿瘤活性,是同为拓扑异构酶I抑制剂SN38(伊立替康的活性代谢产物)的10倍,而SN38的活性是伊立替康的100-1000倍;更重要的是,DXd还具有膜渗透性特点,这是满足T-DXd发挥旁观者效应的必要条件之一[6,7]。
强效的旁观者效应,增强肿瘤杀伤作用并有效克服肿瘤异质性
基于连接子可裂解以及载药膜渗透性的特点,T-DXd具有旁观者效应。且基于较高的DAR以及高活性载药,T-DXd的旁观者效应大大加强。值得一提的是,其旁观者效应仅杀伤旁邻肿瘤细胞,对远处细胞无影响,即在保证疗效的同时,确保系统安全性[10]。
众所周知,HER2表达具有异质性,抗HER2治疗会对肿瘤细胞进行筛选,杀伤对治疗敏感的细胞(HER2高表达,IHC3+和IHC2+/ISH+),而HER2低表达(IHC1+和IHC2+/ISH-)的细胞获得增殖优势,导致耐药。但T-DXd具有强效的旁观者效应,在杀伤HER2高表达肿瘤细胞的同时,也能对HER2低表达肿瘤细胞发挥效应[9],有效克服肿瘤异质性,延缓耐药。
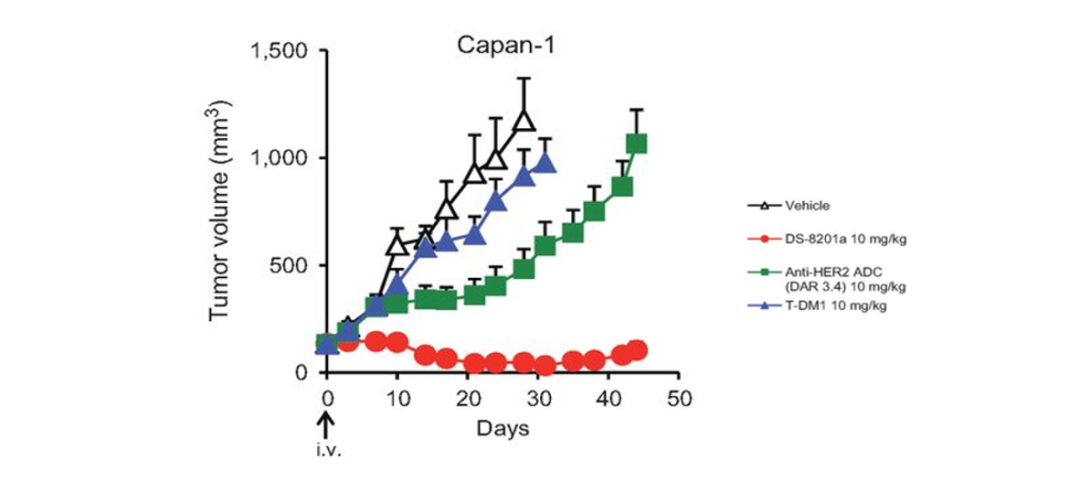
图5. T-DXd的抗肿瘤活性取决于载药[9]
综上所述,T-DXd采用优化的连接子,既能在血液中保持稳定降低脱靶毒性,又能被溶酶体蛋白酶特异性剪切实现载药的高效释放。另外,可裂解的连接子、具有膜渗透性和高活性的载药以及高达8的DAR使得T-DXd具有强效的旁观者效应,杀死肿瘤细胞的同时克服肿瘤异质性。总之,T-DXd的药物特性是其取得突破性临床获益的基础。目前,T-DXd单药或联合治疗已在HER2阳性晚期胃癌中开展了多项临床研究。
大显身手!T-DXd广泛布局HER2阳性晚期胃癌治疗
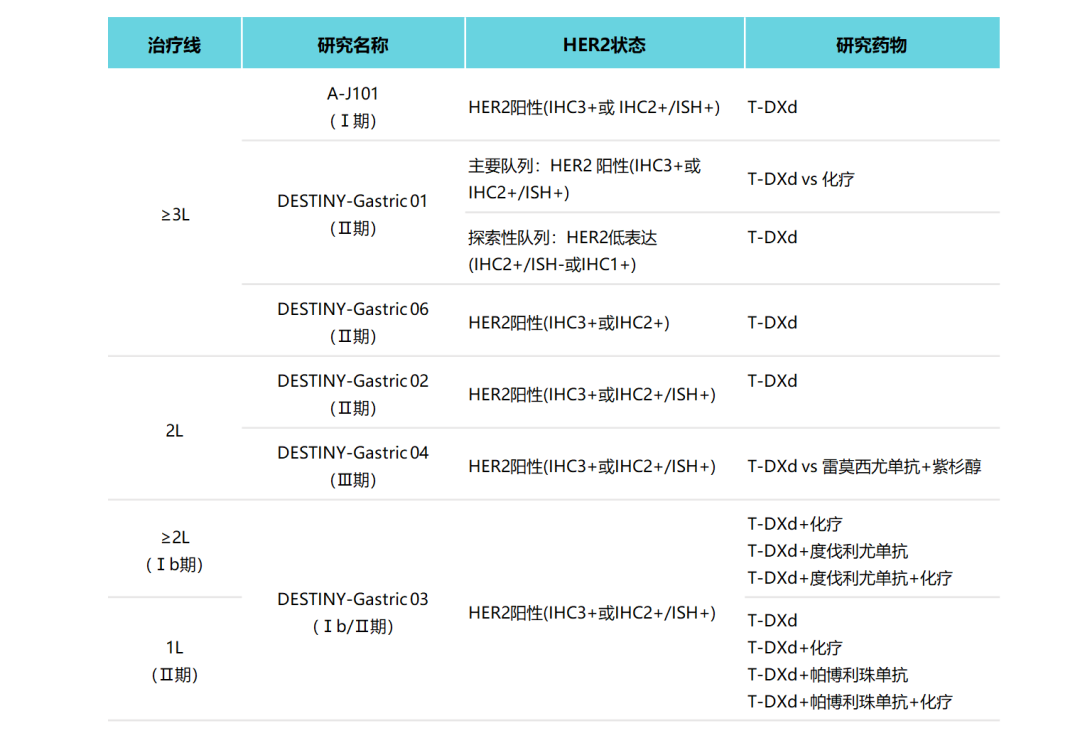
图6. T-DXd在HER2阳性晚期胃癌的研究汇总
01
大放异彩!T-DXd在HER2阳性后线患者中效果显著
一、A-J101研究——T-DXd药物在实体瘤中的初步探索
A-J101研究评估T-DXd在晚期实体瘤患者中的安全性和耐受性。Part1为剂量递增研究, Part2是剂量扩展研究,包含多个队列,其中2b队列纳入HER2阳性、经曲妥珠单抗治疗后胃或胃食管交界处(G/GEJ)腺癌(以下简称胃癌)的患者,RP2D为6.4mg/kg。
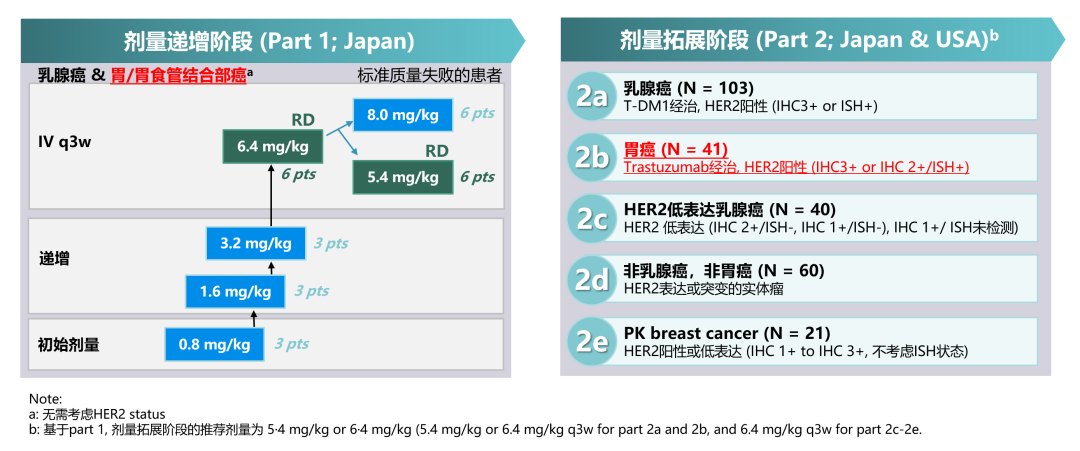
图7. A-J101研究设计[16]
此研究共入组44例患者,27%的患者既往接受过至少5线系统治疗。结果显示,T-DXd单药治疗可强效缩瘤,客观缓解率(ORR)高达43.2%,且中位缓解持续时间(DoR,7.0个月)、中位无进展生存期(PFS)和中位总生存期(OS)分别为5.6个月和12.8个月。≥3级TEAE为64%,无AE导致的药物相关死亡事件发生[16]。
总体而言,T-DXd 的疗效数据令人鼓舞,且安全性可控。A-J101研究初步证实T-DXd在晚期胃癌领域的良好抗肿瘤活性,随后开启了万众瞩目的DESTINY系列研究。
二、DESTINY-Gastric 01研究——胃癌领域第一个证实T-DXd临床获益的随机对照研究
DESTINY-Gastric 01研究在日本和韩国HER2阳性晚期胃癌患者中比较了T-DXd与医生选择的化疗(紫杉醇或伊立替康)作为三线及以后治疗方案的疗效和安全性。该研究成果同步发表于2020年ASCO大会及《新英格兰医学杂志》(NEJM)。研究共纳入187例患者,实验组既往经历四线及以上治疗的患者占20%。初步分析结果显示,T-DXd的疗效与安全性与I期研究和既往报告的T-DXd其他临床研究中观察到的结果大体一致[17]。2022年更新的最终OS分析结果显示,疗效方面,T-DXd组中位OS达12.5个月,显著优于化疗组(8.4个月);T-DXd组ORR为51.3%,是化疗组的3倍多(14.3%);DCR分别为85.7%和62.5%,中位PFS分别为5.6个月和3.5个月。安全性方面,未观察到新的不良事件,整体安全性良好。16例患者发生T-DXd相关的间质性肺病(ILD),多数为1级或2级,未见5级ILD发生[18]。
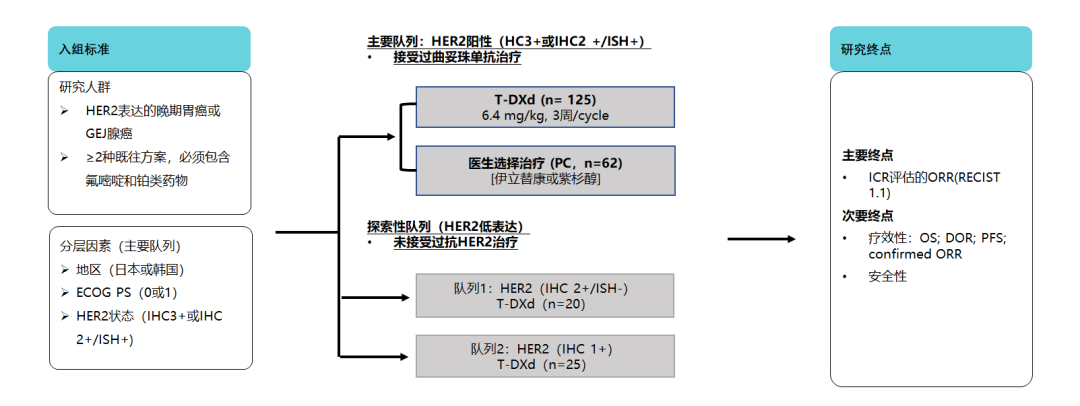
图8. DESTINY-Gastric 01研究设计[17]
经过至少两种治疗进展的HER2阳性晚期胃癌患者,往往结局较差。Ⅰ期A-J101研究初步表明T-DXd在治疗此类患者时在肿瘤缓解率及总生存期方面优势显著,Ⅱ期DESTINY-Gastric 01研究则确证了T-DXd在该患者群体的卓越疗效。T-DXd是首个经随机对照研究证实与化疗相比能显著延长生存时间的抗HER2靶向药物,开启了ADC药物治疗HER2阳性晚期胃癌的新局面。基于DESTINY-Gastric 01主要队列的研究结果,2020年5月T-DXd被美国FDA授予突破性疗法认定(BTD),2021年1月被FDA批准用于治疗接受过含曲妥珠单抗方案的HER2阳性晚期胃癌患者。
并且,2020年ESMO年会中发布的探索性队列研究结果显示,在IHC 2+/ISH-队列中,ORR达36.8%,中位经确认的DoR达7.6个月;在IHC 1+队列中,ORR达19%,中位经确认的DoR为12.5个月[19]。此研究结果表明,T-DXd能助力HER2低表达患者实现生存获益,探索了T-DXd在不同HER2表达胃癌患者中的疗效与安全性,也进一步佐证了T-DXd的结构优势。
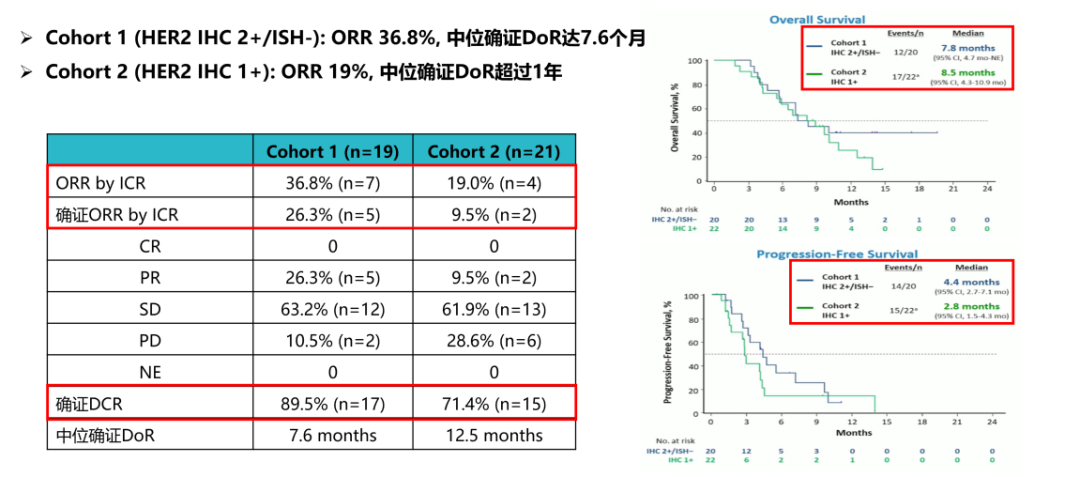
图9. T-DXd用于HER2低表达,实现了长期获益[19]
三、DESTINY-Gastric 06研究——将验证T-DXd在三线及以后中国患者的疗效
DESTINY-Gastric 06研究在中国HER2阳性、既往至少接受过2种系统治疗的晚期胃癌患者中,评估T-DXd三线及以上治疗的疗效及安全性,是DESTINY-Gastric 01研究在中国的桥接试验[20]。该研究正顺利进行,后续结果的公布将继续夯实T-DXd在HER2阳性患者晚期胃癌领域治疗的地位。
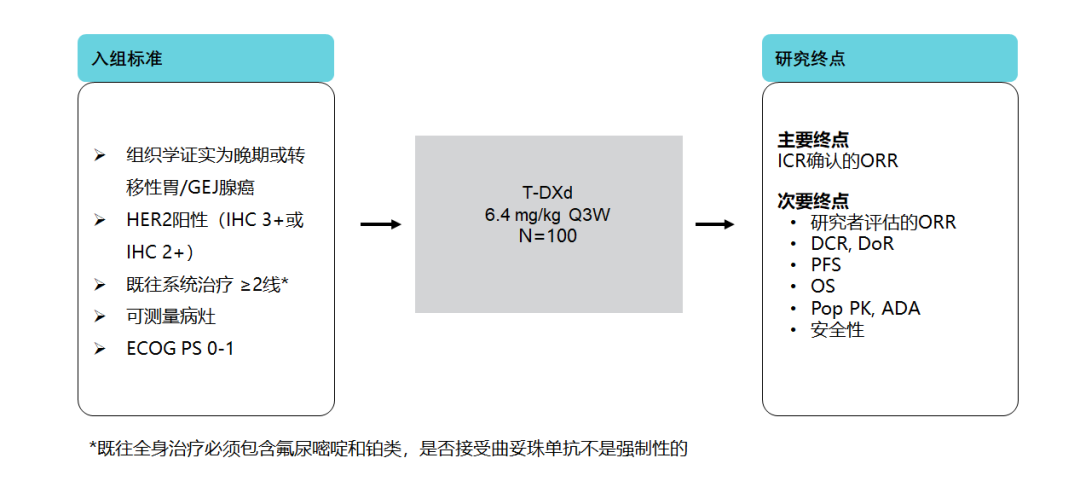
图10. DESTINY-Gastric 06研究设计[20]
四、DESTINY-Gastric 02研究——欧美人群中的数据再验证
该研究评估了T-DXd二线单药治疗HER2阳性不可切除或转移性胃癌在西方人群的疗效和安全性。该研究共纳入79例患者。在疗效方面,ORR达38%,DCR达81%、中位DoR长达8.1个月,中位PFS为5.5个月;在安全性方面,未出现新的安全性信号,与药物相关的ILD和肺炎发生率为7.6%,多数为1级或2级[21]。
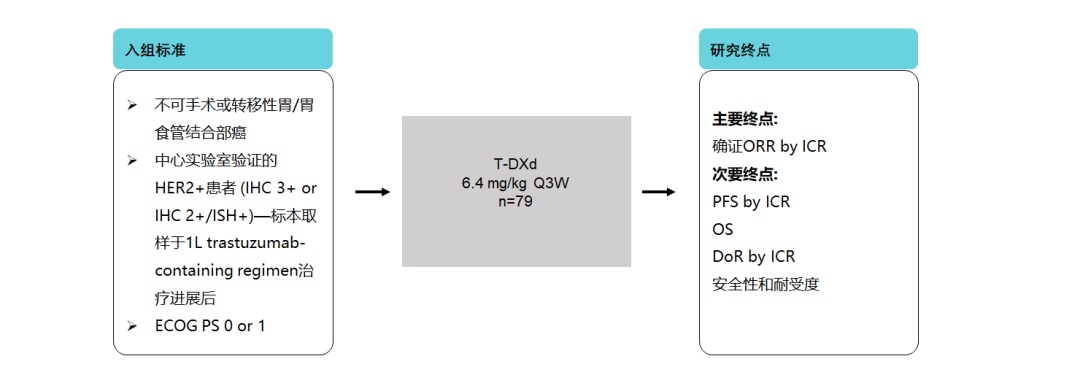
图11. DESTINY-Gastric 02研究设计[21]
五、DESTINY-Gastric 04研究——T-DXd二线单药头对头对比标准方案
2022年《CSCO胃癌诊疗指南》将雷莫西尤单抗联合紫杉醇方案作为HER2阳性晚期胃癌患者二线治疗的Ⅰ级1A类方案,正在进行的DESTINY-Gastric 04研究则将头对头对比此类患者中T-DXd单药与标准方案的疗效与安全性[22]。
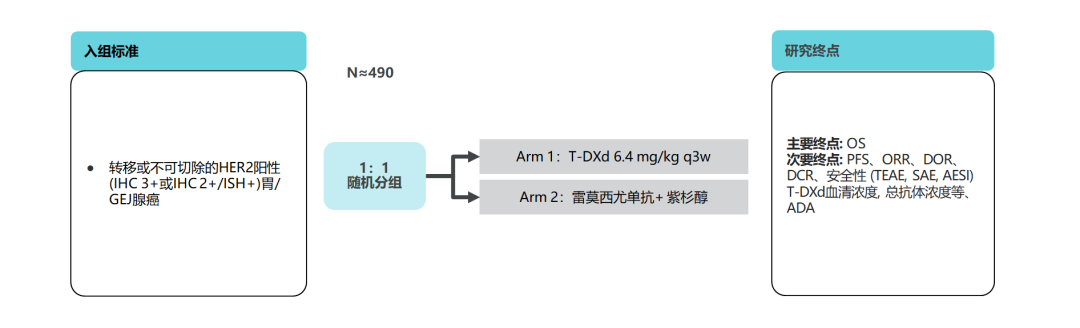
图12. DESTINY-Gastric 04研究设计[22]
02
乘胜追击!探索以T-DXd为核心的治疗新方向,以期惠及更多患者
DESTINY-Gastric 03研究——正在进行中的T-DXd联合治疗模式
上述研究集中于T-DXd单药在后线患者中的疗效与安全性, DESTINY-Gastric 03研究将为大家揭晓以T-DXd为核心的联合方案的疗效与安全性。
DESTINY-Gastric 03研究旨在评估T-DXd单药或联合治疗的安全性和初步抗肿瘤活性,纳入北美、欧洲及亚洲HER2阳性局部晚期或转移性胃癌(IHC 3+ 或2+/ISH+)患者。Part1为剂量递增研究,纳入含曲妥珠单抗方案治疗后进展的HER2阳性胃癌患者;Part2为剂量扩展研究,纳入既往未经治疗、经当地证实的HER2阳性胃癌患者。用药方案将与曲妥珠单抗联合化疗方案直接对比,探索方案包括:T-DXd单药、T-DXd联合化疗,T-DXd联合免疫,T-DXd联合化疗及免疫。
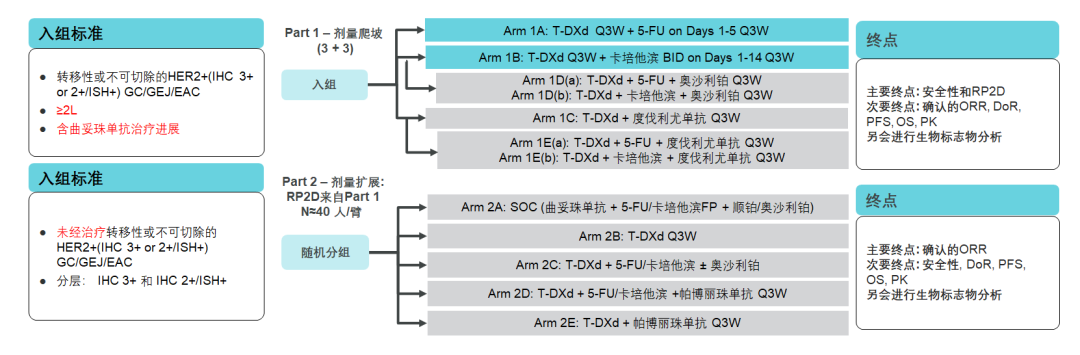
图13. DESTINY-Gastric 03研究[23]
结果表明[24],含曲妥珠单抗方案治疗后进展的HER2 阳性胃癌患者可继续从T-DXd联合化疗中获益,T-DXd联合5-FU组ORR达66.7%,T-DXd联合Cap组ORR达71.4%,PR2D分别是T-DXd 6.4mg/kg+5-FU 600mg/m2,T-DXd 6.4mg/kg+卡培他滨1000mg/m2。
03
入局新辅!T-DXd欲从晚期走向早期
EPOC2003研究——T-DXd在早期胃癌的探索
除晚期战线前移,临床研究也在探索T-DXd作为早期新辅助治疗的方案选择。EPOC2003研究在HER2阳性胃癌患者中评估T-DXd新辅助治疗的抗肿瘤活性[25]。目前,围手术期治疗中也有其他抗HER2治疗的探索,但是尚未成为标准治疗策略,期待T-DXd在HER2阳性胃癌新辅助治疗中带来更大惊喜。
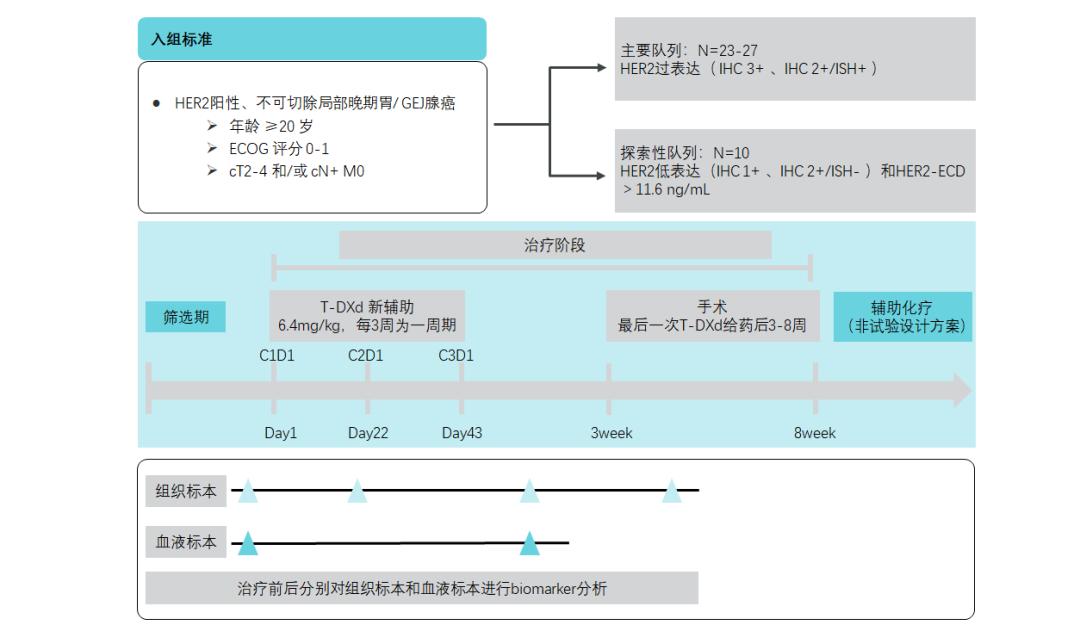
图14. EPOC2003研究设计[25]
总结
A-J101研究初步探索了T-DXd单药在HER2阳性晚期胃癌后线患者中的疗效与安全性,DESTINY-Gastric 01研究基于与化疗的对照证实了T-DXd在这类人群中优异的疗效和安全性。同时,T-DXd在晚期一线、二线也均有注册性研究布局,方案涵盖T-DXd单药和以T-DXd为核心的联合方案。另外,一项研究者发起的研究将探索T-DXd单药在新辅助阶段对HER2阳性胃癌患者的疗效与安全性。
根据DESTINY-Gastric 01研究,T-DXd已分别获得日本(MHLW)和美国(FDA)的批准用于HER2阳性晚期胃癌患者的后线治疗,也写入了2022年《CSCO胃癌诊疗指南》。相信未来T-DXd研究成果的陆续公布将为HER2阳性胃癌患者提供更多治疗选择。
专家简介
白春梅 教授
中国医学科学院北京协和医院,肿瘤内科主任
中国临床肿瘤学会理事会理事
中国临床肿瘤学会神经内分泌肿瘤专家委员会主任委员
中国临床肿瘤学会头颈肿瘤专家委员会常务委员
中国临床肿瘤学会智慧医疗专家委员会常务委员
中国医促会神经内分泌肿瘤分会副主任委员
老年肿瘤学会执行委员
中国研究型医院学会胰腺疾病专业委员会常务委员
擅长领域:抗肿瘤新药的早期研发;肿瘤诊断和治疗,特别是分子标记物在肿瘤诊断、治疗和预后中应用
参考文献:
[1].Bartley AN, Washington MK, Colasacco C, et al. HER2 Testing and Clinical Decision Making in Gastroesophageal Adenocarcinoma: Guideline From the College of American Pathologists, American Society for Clinical Pathology, and the American Society of Clinical Oncology. J Clin Oncol. 2017 Feb;35(4):446-464.
[2].Janjigian YY, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature. 2021 Dec;600(7890):727-730.
[3].Xu Z, Guo D, Jiang Z, et al. Novel HER2-Targeting Antibody-Drug Conjugates of Trastuzumab Beyond T-DM1 in Breast Cancer: Trastuzumab Deruxtecan(DS-8201a) and (Vic-)Trastuzumab Duocarmazine (SYD985). Eur J Med Chem. 2019 Dec 1;183:111682.
[4].Nishida Y, Kuwata T, Nitta H, et al. A novel gene-protein assay for evaluating HER2 status in gastric cancer: simultaneous analyses of HER2 protein overexpression and gene amplification reveal intratumoral heterogeneity. Gastric Cancer. 2015 Jul;18(3):458-66.
[5].Yao X, Jiang J, Wang X, et al. A novel humanized anti-HER2 antibody conjugated with MMAE exerts potent anti-tumor activity. Breast Cancer Res Treat. 2015 Aug;153(1):123-33.
[6].Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
[7].Skidmore L, Sakamuri S, Knudsen NA, et al. ARX788, a Site-specific Anti-HER2 Antibody-Drug Conjugate, Demonstrates Potent and Selective Activity in HER2-low and T-DM1-resistant Breast and Gastric Cancers. Mol Cancer Ther. 2020 Sep;19(9):1833-1843.
[8].Tsuchikama K, An Z. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46.
[9].Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin Cancer Res. 2016 Oct 15;22(20):5097-5108.
[10].Zhang W, Wang S, Wang Q, Yang Z, Pan Z, Li L. Overexpression of cysteine cathepsin L is a marker of invasion and metastasis in ovarian cancer. Oncol Rep. 2014 Mar;31(3):1334-42.
[11].Marcoux J, Champion T, Colas O, et al. Native mass spectrometry and ion mobility characterization of trastuzumab emtansine, a lysine-linked antibody drug conjugate. Protein Sci. 2015;24(8):1210-1223.
[12].Conilh L, Fournet G, Fourmaux E, et al. Exatecan Antibody Drug Conjugates Based on a Hydrophilic Polysarcosine Drug-Linker Platform. Pharmaceuticals (Basel). 2021 Mar 9;14(3):247.
[13].Zhang J, Ji D, Shen W, et al. Phase I Trial of a Novel Anti-HER2 Antibody-Drug Conjugate, ARX788, for the Treatment of HER2-Positive Metastatic Breast Cancer. Clin Cancer Res. 2022 Jun 29:OF1-OF10.
[14].Krop IE, Beeram M, Modi S, et al. Phase I study of trastuzumab-DM1, an HER2 antibody-drug conjugate, given every 3 weeks to patients with HER2-positive metastatic breast cancer. J Clin Oncol. 2010 Jun 1;28(16):2698-704.
[15].Nagai Y, Oitate M, Shiozawa H, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys. Xenobiotica. 2019 Sep;49(9):1086-1096.
[16].Shitara K, Iwata H, Takahashi S, et al. Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study. Lancet Oncol. 2019 Jun;20(6):827-836.
[17].Shitara K, Bang YJ, Iwasa S, et al; DESTINY-Gastric01 Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med. 2020 Jun 18;382(25):2419-2430.
[18].Trastuzumab deruxtecan (T-DXd; DS-8201) in pati ents with HER2–positive advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Final overall survival (OS) results from a randomized, multicenter, open-label, phase 2 study (DESTINY-Gastric01). 2022 ASCO GI Abstract. 242.
[19].Trastuzumab deruxtecan (T-DXd; DS-8201) in patients with HER2-low, advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: Results of the exploratory cohorts in the phase II, multicenter, open-label DESTINY-Gastric01 study. 2020 ESMO Mini Oral 1422.
[20].https://clinicaltrials.gov/ct2/show/NCT04989816
[21].Primary Analysis of a Phase 2 Single-Arm Trial of Trastuzumab Deruxtecan (T-DXd) in Western Patients With HER2-Positive (HER2+) Unresectable or Metastatic Gastric or Gastroesophageal Junction (GEJ) Cancer Who Progressed on or After a Trastuzumab-containing Regimen.2021 ESMO. Abstract LBA55.
[22].https://clinicaltrials.gov/ct2/show/NCT04704934
[23].https://clinicaltrials.gov/ct2/show/NCT04379596
[24].Dose-escalation and dose-expansion study of trastuzumab deruxtecan (T-DXd) monotherapy and combinations in patients (pts) with advanced/metastatic HER2+ gastric cancer (GC)/gastroesophageal junction adenocarcinoma (GEJA): DESTINY-Gastric03. 2022 ASCO GI. Abstract 295.
[25].Phase 2 study of trastuzumab deruxtecan in the neoadjuvant treatment for patients with HER2-positive gastric and gastroesophageal junction adenocarcinoma (EPOC2003). 2022 ASCO. Abstract TPS4161.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |