9月28日是国际Previvor日,Previvor一词特指成千上万的男性或女性携带癌症相关突变基因或癌症发生的高风险人群,而这类人群的肿瘤筛查与家系的长期管理越来越受到各个相关学科肿瘤医生的重视。《医师报》特邀中国科学技术大学附属第一医院妇产科周颖教授介绍了Previvor定义及该类型人群的长期管理策略,她表示重视BRCA1/2突变的Previvor人群的管理及肿瘤筛查、家系管理非常重要。

01
何为Privivor?
BRCA1/2致病或疑似致病突变基因的携带者,在未发生肿瘤之前,被称为Previvor。欧美的研究报道,携带 BRCA1 和BRCA2 突变的欧美Previvor预期寿命若为 80 岁,则累积乳腺癌发病风险分别为 72% 和 69%,且家系中有 2 例及以上乳腺癌患者的Previvor其乳腺癌发病风险是无家族史携带者的2倍左右。携带 BRCA1 基因突变的女性终生卵巢癌发病风险为 48.3%,而携带 BRCA2 基因突变的女性终生卵巢癌发病风险为 20.0%。
而中国的研究还发现, BRCA1/2 突变的乳腺癌患者的 10 年内对侧乳腺癌累积风险分别为 15.5% 和 17.5%,是非突变携带者的 4~5 倍;若存在家族史,则10 年对侧乳腺癌发病风险增加至27%。值得重视的是,尽管中国乳腺癌 BRCA1/2 整体突变频率与欧美人群相似,但突变谱存在较大差异: 欧美人群中 BRCA1 突变频率高于 BRCA2;而中国乳腺癌患者中,BRCA2 突变频率高于 BRCA1;且约 30%~40% 的 中国乳腺癌患者BRCA1/2 突变位点未在欧美人群中发现,可能是中国人群特异的位点。
BRCA1 突变乳腺癌中约 60% 表现为三阴性乳腺癌;具有发病年龄早的特点,平均发病年龄较散发性乳腺癌患者早 5~8 年:其中 BRCA1/2 突变的乳腺癌约 30% 表现为早发性乳腺癌(发病年龄≤40 岁);而无 BRCA1/2 突变的乳腺癌,仅 17% 左右为早发性乳腺癌。卵巢癌BRCA1 突变者的平均发病年龄为 49.7 岁,BRCA2 突变者平均发病年龄为 52.4 岁。
02
HBOC 的同期癌与异时癌
同期癌(Synchronous carcinoma) :第二个肿瘤发生时间距离第一个肿瘤间隔不超过6个月;异时癌(metachronous carcinoma):第二个肿瘤发生时间距离第一个肿瘤间隔6个月以后;一般认为:同期癌与异时癌均与遗传因素有关;诊断需要病理证实。
2022年日本的研究报道:BRCA1致病性突变携带者到85岁时累积发病风险:乳腺癌 (72.5%)、卵巢癌(65.6%)、胃癌(21.3%)、胰腺癌(16.0%)、胆管癌(11.2%)。BRCA2致病性突变携带者到85岁时累积发病风险 :乳腺癌(58.3%)、前列腺癌(24.5%)、胃癌(19.3%)、卵巢癌(14.8%)、胰腺癌(13.7%)、食管癌(5.2%)。部分患者还可以发生2种以上的肿瘤。
卵巢癌的死亡率位列妇科恶性肿瘤之首,其中10%~15% 的卵巢癌(包括输卵管癌和腹膜癌)与遗传因素有关,遗传性卵巢癌综合征(hereditary ovarian cancer syndrome,HOCS)是一种涉及卵巢癌易感性增高的常染色体显性遗传综合征。HOCS 包括遗传性位点特异性卵巢癌综合征(hereditary site specific ovarian cancer syndrome,HSSOCS)、遗传性乳腺癌卵巢癌综合征(hereditary breast and ovarian cancer,HBOC)、林奇综合征(Lynch syndrome,LS)及其他肿瘤综合征伴发遗传性卵巢癌等。其中HBOC是特指一个家族中有 2个一级亲属或 1 个一级亲属和 1 个二级亲属患乳腺癌或卵巢癌,且具有遗传倾向,主要是由 BRCA1 或BRCA2 突变引起。HSSOCS 是 HBOCS 的变异情况,是指家族中有≥ 2 个一级或一级及二级亲属同患卵巢癌;其发病也主要与 BRCA1/2 基因突变相关,同源重组(homologous recombination,HR)通路上的小部分基因突变也参与发病机制。BRCA1/2突变的卵巢癌具有典型的SET病理结构。
美国的临床研究发现,乳腺癌患者后期发生卵巢癌平均间隔时间 45个月(约4年);而卵巢癌后期发生乳腺癌平均间隔时间 86个月(约7年);无论是同期癌还是异时癌,患者死亡的原因多为卵巢癌的复发。
03
BRCA1/2突变的乳腺癌患者的内膜管理
绝经前激素受体阳性的早期乳腺癌患者:术后标准内分泌治疗方案为他莫昔芬(TAM)治疗 5~10年; 而TAM长期使用过程中有发生子宫内膜增生、不典型增生、子宫内膜癌和子宫肉瘤的风险; 服用TAM后发生子宫内膜癌的风险增加 2~6 倍,且呈剂量和时间依赖性;TAM 所致的内膜息肉的恶变率为 3%,而普通内膜息肉的恶变率为0.48%。需要注意的是:2018年JNCCN的研究报道BRCA1突变人群预防性切除双附件后,Previvor人群仍然可以发生子宫内膜癌,主要亚型为浆液性腺癌。因此,BRCA1突变人群是否推荐使用TAM仍然值得商榷,需要大量临床数据探索。
BRCA1/2突变的乳腺癌患者,若坚持使用他莫昔芬治疗,推荐使用之前进行内膜厚度的监测,若无异常再考虑使用,治疗期间注意避孕,并每6~12个月行1次妇科检查,通过B超检查了解子宫内膜厚度。 乳腺癌术后口服 TAM 治疗后子宫内膜异常增厚的诊断标准如下:①绝经前子宫内膜厚度≥12 mm;②绝经后子宫内膜厚度≥5 mm。 若内膜厚度异常时行宫腔镜检查,必要时子宫内膜活检;患者出现持续或反复阴道流血者,无论内膜厚薄、绝经前、后都应该做宫腔镜检查及内膜活检。
04
BRCA1/2突变的高风险人群的卵巢健康管理
2019年NCCN指南推荐高风险人群(BRCA1/2、RAD51C、RAD51D、BRIP1突变)完成生育要求后,BRCA1突变&40岁;BRCA2突变&50岁行预防性输卵管卵巢切除术(risk-reducing salpingo-oophorectomy,RRSO),RAD51C, RAD51D, BRIP1突变可在绝经后完成;这是目前对于携带BRCA1/2突变为主的患者降低卵巢癌风险最有效的策略。
已经报道,手术可将BRCA1或BRCA2突变女性的卵巢癌、输卵管癌或腹膜癌的风险降低约80%,并能够降低总体病死率。对于绝经前期妇女,卵巢切除术还降低了罹患乳腺癌的风险。人口统计学数据证实,中危人群接受双侧输卵管切除术者,患卵巢癌的风险降低65%。基于特定的基因突变、患者的生育要求和家族史,手术时机及术式可以因人而异。
RRSO手术切除的卵巢和输卵管都应按 SEE-FIM(sectioning extensively examining the fimbriated end)方案病理诊断:整个输卵管,尤其是远端部分,应送病理,应仔细检查卵巢,有无并存的子宫内膜异位囊肿、腺纤维瘤或其他可能作为肿瘤发生瘤巢(nidus)的良性病变。卵巢和输卵管必须进行分段取材病理检查,并且如发现有隐匿恶性疾病或确诊浆液性输卵管上皮内癌(Serous tubal intraepithelial carcinoma, STIC)或浆液性输卵管上皮内病变(Serous tubal intraepithelial lesions, STIL),转诊至妇科肿瘤专科医师进行后续治疗随访。病理诊断STIC需要三个条件:即HE形态符合或者怀疑STIC,加上p53突变以及Ki67&10%的免疫组化结果。若考虑保留卵巢功能,也可以进行预防性输卵管切除和延迟卵巢切除术(risk-reducing early salpingectomy and delayed oophorectomy,RRESDO):先行预防性切除双侧输卵管,绝经后再追加卵巢切除。
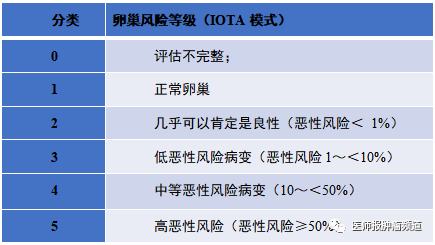
针对未完成生育或拒绝行双侧附件切除的Previvor人群,推荐每半年进行卵巢B超评估,即卵巢肿瘤分层管理系统(O-RADS 2020年标准),我们中心已经常规开展。3类以上结果需要检测CA125水平并进行转诊:3类需要严密随访或手术治疗,4~5类推荐妇科肿瘤医生评估手术治疗。
2020年O-RADS标准
05
周颖教授总结
重视BRCA1/2突变的Previvor人群的管理及肿瘤筛查、家系管理非常重要。BRCA1/2突变人群的乳腺筛查管理:推荐25岁开始 乳腺MRI/每年;30岁 乳腺钼靶与MRI/每年交替;生育之前进行O-RADS分层管理,完成生育后推荐行RRSO(预防性切除双附件)或RRESDO(预防性切除双侧输卵管、延迟性切除双侧卵巢术)手术,术后仍需随访8年,警惕腹膜癌的发生。我们中心的生殖中心同步开展了遗传性卵巢癌致病突变胚胎植入前遗传学阻断技术,可以阻断BRCA1/2携带者的出生,从而阻断BRCA1/2相关的各种恶性肿瘤的家族遗传。
专家简介

周颖 教授
中国科学技术大学附属第一医院
产科科室副主任,博士,研究员、副主任医师
中国科学技术大学附属第一医院妇产科博士生导师、博士后流动站指导老师
第九批安徽省学术和技术带头人后备人选
第九届“安徽省青年科技创新奖”杰出奖获得者
中华预防医学会生殖健康分会委员
中华医学会安徽省医学会妇产科学分会第十届委员
安徽省抗癌协会妇科肿瘤专业委员会常委
中华医学会安徽省分会妇产科学分会第十届委员会妇科肿瘤学组成员
中国优生科学协会生殖道疾病诊治分会青年委员
中国医师协会微无创医学专业委员会临床研究与质控专业委员会委员
安徽省抗癌协会卵巢癌专业委员会第一届委员会常务委员
排版:李慧
编辑:王丽娜
| 留言与评论(共有 0 条评论) “” |