*仅供医学专业人士阅读参考
哪些旁路耐药机制需要重点关注?这里有答案!
针对EGFR突变的酪氨酸激酶抑制剂(TKI)类靶向药,一直引领着非小细胞肺癌(NSCLC)靶向治疗的发展潮流,目前EGFR-TKI已经发展到第三代,奥希替尼是目前国内外公认的EGFR突变晚期NSCLC一线治疗标准方案,相比一代EGFR-TKI有着全方位的临床获益。
但一些临床工作者乃至患者,仍然担忧奥希替尼耐药后不容易处理,为此就需要进一步明确奥希替尼的耐药机制,并确定相应的治疗方案。之前我们已经和大家分享了奥希替尼主要耐药机制C797S、MET扩增和HER2扩增/突变的应对策略,本文将介绍奥希替尼一线治疗后的EGFR20号外显子插入突变(EGFR Ex20ins)、PIK3CA突变、RET融合、BRAF等多种旁路耐药机制发生率,并结合临床病例报告,阐释相应的处理策略。
01
同时延长OS和PFS,为奥希替尼树立一线标准方案地位
临床III期FLAURA研究,至今仍是EGFR-TKI用于晚期NSCLC一线治疗的“标杆”:在无进展生存期(PFS)方面,奥希替尼治疗患者的中位PFS达到18.9个月,显著优于研究中的对照组第一代TKI以及第二代TKI;而在总生存期(OS)方面,奥希替尼组患者中位OS为38.6个月,是目前在一线治疗中,唯一带来OS显著获益的EGFR-TKI[1-2](见图1)。
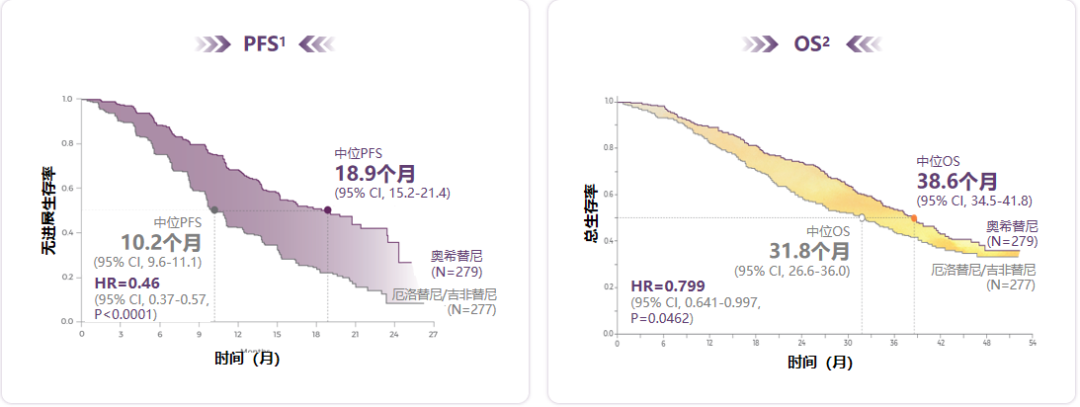
图1.奥希替尼PFS获益明确,并成功显著延长患者中位OS
奥希替尼不仅对患者全身病灶有良好的疗效,还能够有效穿越血脑屏障、控制NSCLC患者常见的脑转移,同时其治疗相关的不良事件(AEs)发生率也较低,在FLAURA研究中表现出比第一代EGFR-TKI更好的安全性,从而实现了疗效和安全性的双重优势。
基于上述优势,奥希替尼被美国国家综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)、中国临床肿瘤学会(CSCO)等国内外权威指南的推荐,成为EGFR突变阳性晚期NSCLC一线治疗的标准乃至优选方案(图2)。

图2.国内外指南对奥希替尼一线治疗的推荐现状
但与其它癌症靶向治疗药物一样,奥希替尼也同样会出现继发性治疗耐药,且与第一代/第二代EGFR-TKI不同,奥希替尼呈现的是“碎片化耐药”,其中包括EGFR基因的继续突变,以及EGFR Ex20ins、PIK3CA突变、RET融合、BRAF突变等形形色色的旁路耐药机制。
02
盘点旁路耐药机制,临床应该如何应对?
01
EGFR Ex20ins
在奥希替尼用于晚期NSCLC二线治疗的AURA3研究中,曾报告1例因出现EGFR Ex20ins,而对奥希替尼继发性耐药的患者,但仅占接受分析患者的1%(1/83),可见EGFR Ex20ins是相对罕见的奥希替尼耐药机制[3]。
EGFR Ex20ins对传统第一代/第二代EGFR-TKI的应答不佳,不过两项临床II期研究(EA5162、POSITION20)的数据显示,将奥希替尼治疗剂量增至160 mg,对EGFR Ex20ins具有一定疗效,治疗的客观缓解率(ORR)分别为24%和33%(见图3),用于奥希替尼耐药患者的疗效则有待评估[4-5];此外,近年来还有多种专门针对EGFR Ex20ins的新一代EGFR-TKI及单抗类药物问世,比如莫博赛替尼、Amivantamab等,也有望用于对奥希替尼耐药的患者。
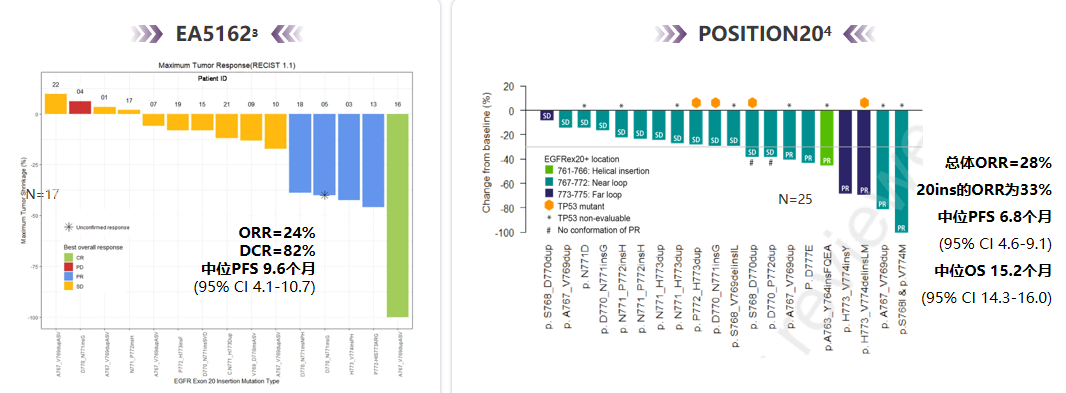
图3.两项使用160mg奥希替尼治疗EGFR Ex20ins的临床研究疗效汇总
02
PIK3CA突变
PIK3CA突变可激活PI3K-AKT通路,导致对奥希替尼治疗的旁路耐药,汇总FLAURA、ORCHARD两项奥希替尼一线治疗临床研究数据的分析显示,PIK3CA功能获得性突变在复发患者中的发生率为11%。而奥希替尼联合针对PI3K通路的PIK3CA抑制剂(如alpelisib、AZD8186等)、AKT抑制剂(如capivasertib)等新型靶向治疗药物,则在临床前研究中表现出了抗肿瘤活性,有望用于破解耐药[6],但疗效仍需临床研究验证。
03
RET融合
AURA3研究的耐药机制分析中,有1例患者(1%)存在RET-ERC1融合导致的耐药[3],后续又有多份病例报告提示,CD6-RET、NCOA4-RET及MYH9-RET等RET融合,均可能导致患者对奥希替尼治疗耐药,且在奥希替尼一线和二线治疗耐药中均可能出现[7]。
而专门针对RET的两种TKI类靶向药,即普拉替尼和Selpercatinib,均被证明在联合奥希替尼使用时,能够破解RET融合导致的治疗耐药。如普拉替尼联合奥希替尼的研究中,治疗两例耐药患者的初步缩瘤比例高达78%[8];另一项来自纪念斯隆-凯特琳癌症中心的分析数据显示,在10例接受奥希替尼80mg+Selpercatinib治疗的RET融合耐药患者中,有5例经治疗可达到部分缓解,且中位缓解持续时间(DoR)达11个月[9]。
04
BRAF突变/融合
在FLAURA及AURA3研究的耐药机制分析中,分别有3%(3/91)和4%(3/83)的患者检出了BRAF V600E突变耐药[4,10],此外还有研究报告了由BRAF基因融合(如AGN-BRAF)导致的奥希替尼治疗耐药[11-12]。临床前研究及病例报告显示,针对BRAF通路的BRAF抑制剂或MEK抑制剂,如已在我国获批的达拉非尼、维莫非尼、曲美替尼等药物,或可与奥希替尼联合使用,以破解BRAF基因变异导致的耐药。
2019年在Journal of Thoracic Oncology上介绍了一例使用奥希替尼+达拉非尼+曲美替尼三药联合应对耐药的病例,患者使用奥希替尼治疗进展后,基因检测发现BRAF V600E突变,换用了奥希替尼+达拉非尼+曲美替尼三药联合治疗方案,使病情再度得到控制,疗效评价为疾病稳定(SD),截至报告时患者的PFS超过7.4个月(见图4)[13]。
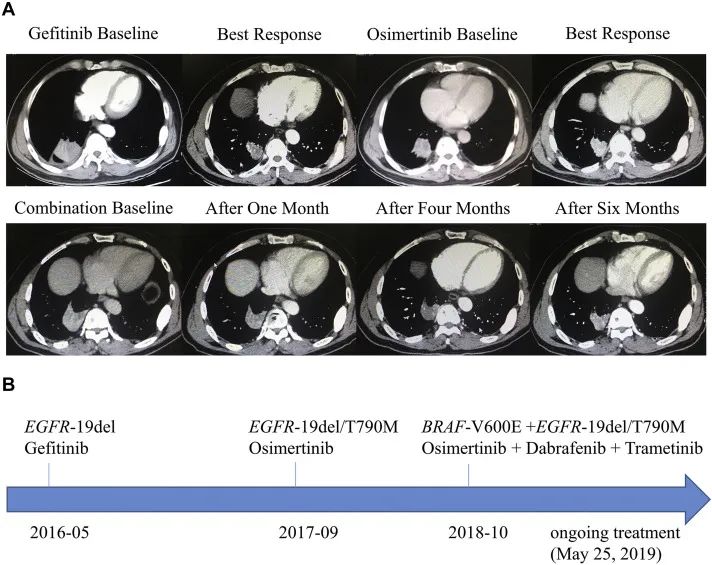
图4.奥希替尼+达拉非尼+曲美替尼三药联合,应对耐药的治疗经过
03
专家点评:破解奥希替尼旁路耐药,前景可期
奥希替尼的治疗耐药机制日益清晰,本文介绍的EGFR Ex20ins、PIK3CA突变、RET融合、BRAF突变,都属于发生率不高的旁路耐药机制,但从临床前研究和病例报告来看,以奥希替尼为基础、配合相应通路的针对性治疗药物,有望较好地应对耐药、再度控制患者病情进展。
专家简介

操乐杰 教授
中国科大附一院、安徽省立医院 呼吸与危重症科 主任医师、教授、江淮名医
中国肺癌早期诊疗协作组常委
中国抗癌协会肺癌专委会全国常委
CSCO血管靶向专委会全国常委
中国医药教育协会肿瘤免疫与呼吸康复专委会常委
中国抗癌协会肿瘤靶向专委会全国委员
安徽省抗癌协会肺癌早期诊疗协作组主委
安徽省抗癌协会肿瘤免疫与靶向治疗专委会主委
中华医学会/中国医师协会安徽省呼吸分会常委
安徽省抗癌协会肺癌专委会副主任委员
中华医学会结核病分会全国委员
参考文献:
[1].Soria J C, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer[J]. New England Journal of Medicine, 2018, 378(2): 113-125.
[2].Ramalingam S S, Vansteenkiste J, Planchard D, et al. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC[J]. New England Journal of Medicine, 2020, 382(1): 41-50.
[3].Papadimitrakopoulou V A, Wu Y L, Han J Y, et al. Analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study[J]. Annals of Oncology, 2018, 29(Supplement 8): viii741.
[4].Piotrowska Z, Wang Y, Sequist L V, et al. ECOG-ACRIN 5162: a phase II study of osimertinib 160 mg in NSCLC with EGFR exon 20 insertions[J]. Journal of Clinical Oncology, 2020, 38(Suppl_15): 9513.
[5].Zwierenga F, van Veggel B, Hendriks L E L, et al. High dose osimertinib in patients with advanced stage EGFR exon 20 mutation-positive NSCLC: Results from the phase 2 multicenter POSITION20 trial[J]. Lung Cancer, 2022, 170: 133-140.
[6].Grazini U, O'Neill D J, Martin M, et al. PIK3CA and PTEN mutations as drivers of osimertinib resistance in patients with NSCLC[J]. Cancer Research, 2022, 82(12_Supplement): 5353.
[7].Ríos-Hoyo A, Moliner L, Arriola E. Acquired Mechanisms of Resistance to Osimertinib—The Next Challenge[J]. Cancers, 2022, 14(8): 1931.
[8].Piotrowska Z, Isozaki H, Lennerz J K, et al. Landscape of Acquired Resistance to Osimertinib in EGFR-Mutant NSCLC and Clinical Validation of Combined EGFR and RET Inhibition with Osimertinib and BLU-667 for Acquired RET Fusion[J]. Cancer Discovery, 2018, 8(12): 1529-1539.
[9].Rotow J, Patel J, Hanley M, et al. FP14. 07 combination osimertinib plus selpercatinib for EGFR-mutant non-small cell lung cancer (NSCLC) with acquired RET fusions[J]. Journal of Thoracic Oncology, 2021, 16(3): S230.
[10].Ramalingam S S, Cheng Y, Zhou C, et al. Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study[J]. Annals of Oncology, 2018, 29(Supplement 8): viii740.
[11].Roper N, Brown A L, Wei J S, et al. Clonal evolution and heterogeneity of osimertinib acquired resistance mechanisms in EGFR mutant lung cancer[J]. Cell Reports Medicine, 2020: 100007.
[12].Vojnic M, Kubota D, Kurzatkowski C, et al. Acquired BRAF rearrangements induce secondary resistance to EGFR therapy in EGFR-mutated lung cancers[J]. Journal of Thoracic Oncology, 2019, 14(5): 802-815.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |