*仅供医学专业人士阅读参考
新型药物在HER2-low乳腺癌中取得突破,使HER2-low作为新的乳腺癌治疗分型,目前针对这一人群的药物有哪些、病理检测的进展如何、进一步探索方向是什么?
HER2-low(IHC 1+或IHC 2+/ISH-)肿瘤患者约占整体乳腺癌人群的50%,尽管既往抗HER2治疗改善了HER2阳性乳腺癌的生存结局,但是在HER2-low人群中却不尽人意,基于此,过去HER2-low乳腺癌往往被纳入HER2阴性范畴,不适合接受抗HER2治疗。但是随着包括新型ADC药物如T-DXd、SYD985以及双特异性抗体Zenocutuzumab等都在HER2-low乳腺癌人群中显示出治疗获益,并且发现在HER2-low和HER2 IHC-0乳腺癌之间可能存在一些生物学和患者预后的差异,这些都提示HER2-low可能可以作为一种独特的、临床相关的乳腺癌分型,值得开展进一步研究探索以提供诊断和治疗HER2-low乳腺癌的优化策略。

近期发表在《美国医学会杂志》(The Journal of the American Medical Association,JAMA)上的一篇报道“An Overview of Clinical Development of Agents for Metastatic or Advanced Breast Cancer Without ERBB2 Amplification(HER2-Low)”,全面综述了HER2-low乳腺癌的流行病学、生物学特征、诊断技术、治疗进展以及未来探索方向等内容,为更好的了解HER2-low乳腺癌提示了重要方向。
HER2-low乳腺癌的
生物学和临床特征概览
▌流行病学
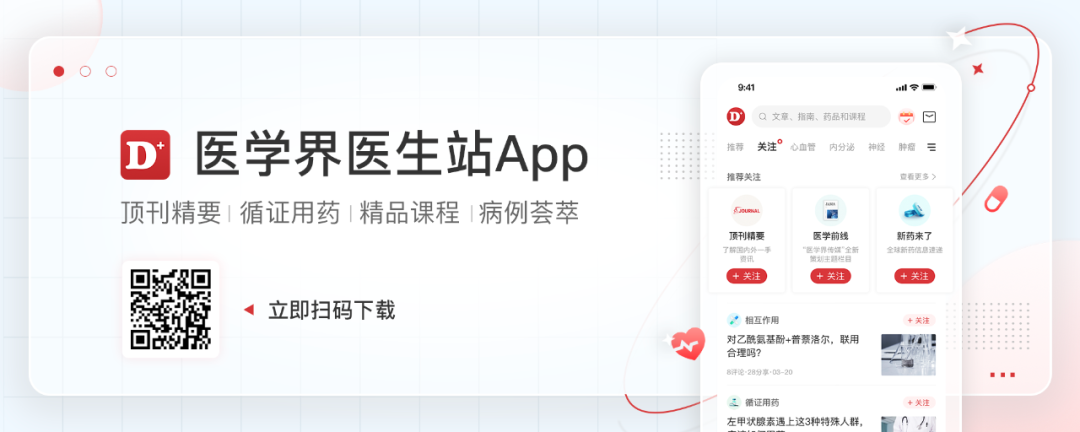
目前研究报告中,HER2-low在乳腺癌中的占比约为31.0%-61.6%,不同的研究中发生率有所不同。HER2-low更常见于HR阳性乳腺癌,在一项评估HER2-low乳腺癌患病率的研究中(n=3727,纳入患者人数迄今最多),55.2%的HR阳性乳腺癌和28.1%的HR阴性乳腺癌中存在HER2-low。
表1.HER2-low乳腺癌流行病学相关研究
HER2-low的生物学特征
和在肿瘤演变中的作用
HER2-low原发肿瘤相比HER2 IHC-0肿瘤可能体积更大,并且更可能淋巴结阳性。在一项纳入121例转移性乳腺癌(mBC)患者的回顾性分析中,HER2-low肿瘤最常见的表型是luminal B型,该表型在HER2-low肿瘤(65.7%)中相比HER2-0肿瘤(37.0%)中更普遍。另外在一项纳入285例HER2-low早期乳腺癌患者的研究中,高达82.8%的患者为luminal型。然而,在一项针对389例患者的研究中,HER2-low和HER2-0 mBC患者之间在人口统计或临床特征方面并未观察到显著差异。
HER2-low在乳腺癌中的占比可能取决于HR状态,在一项纳入3689例HER2阴性乳腺癌患者的研究中,使用PAM50亚型分类,HR阳性HER2-low肿瘤中,58.9%为luminal A型、33.4%为luminal B型、3.0%为HER2过表达、1.9%为基底细胞样型、2.8%为正常乳腺样型。在同一研究中,与HR阳性和HER2-0肿瘤相比,HER2-low肿瘤表达更高水平的luminal相关基因,但增殖相关基因的表达水平更低。而在三阴性乳腺癌(TNBC)中,HER2-low和HER2-0肿瘤之间未发现基因表达差异。该研究结果表明,相比HR阳性肿瘤,在HR阴性肿瘤中HER2-low和HER2-0的肿瘤更相似,尽管还需要进一步的研究来阐明其意义。
在一项纳入121例mBC患者的回顾性分析中,通过下一代基因测序比较了HER2-0与HER2-low乳腺癌,并识别潜在的生物标志物。HER2-low和HER2-0肿瘤中最常见的突变基因为TP53(分别为34.3%和48.2%)和PIK3CA(分别为31.3%和35.2%);与HER2-0(1.8%)肿瘤相比,HER2-low(12.0%)肿瘤中FGFR1扩增更明显。此外,PDGFRA和MYC扩增在HER2-low肿瘤相比HER2-0肿瘤更常见(PDGFRA,2.3%vs 0.28%;MYC,8.1%vs 4.6%)。此外,还观察到HER2-low肿瘤携带BRCA1/2和其他乳腺癌易感基因的发生率低于HER2-0肿瘤。
指南建议在肿瘤复发时需要对肿瘤进行再次活检,以重新评估生物标志物,包括HER2。这是因为多项研究表明随着疾病进展,肿瘤HER2表达状态可能会发生变化。多项研究显示,(既往非HER2-low的)肿瘤在发生疾病进展时可能会产生HER2-low表达。尽管HER2表达状态之间的差异可能部分归因于取样错误或对原始标本结果的错误判读,但这些数据意味着患者既往的HER2评分可能可靠地评估肿瘤复发时的HER2-low状态。一项442例乳腺癌患者的回顾性分析中,HER2-low表达在mBC复发病例中(57%)比原发性mBC(43%)或早期乳腺癌(44%0中更常见。在一项针对547例乳腺癌患者的研究中,观察到15%的原发性肿瘤中HER2-0患者在复发时变为HER2-low。并且从HER2-0转换为HER2-low在HR阳性肿瘤中的发生频率高于HR阴性肿瘤。一项19例HR+/HER2-乳腺癌患者的研究中,16例(84%)患者观察到了表达HER2的循环肿瘤细胞,并且HER2阳性细胞的比例随着疾病进展而增加。此外,已有研究发现HR+/HER2-乳腺癌(包括无HER2扩增或HER2激活突变的乳腺癌)的获得性内分泌治疗(ET)耐药与HER2表达有关。并且在ET耐药中还可能观察到HER2突变的发生,例如一项纳入在ET治疗期间疾病进展的HR+/HER2-mBC患者的研究中,其中8.4%的患者在疾病进展时观察到获得性HER2突变。
HER2-low的预后意义
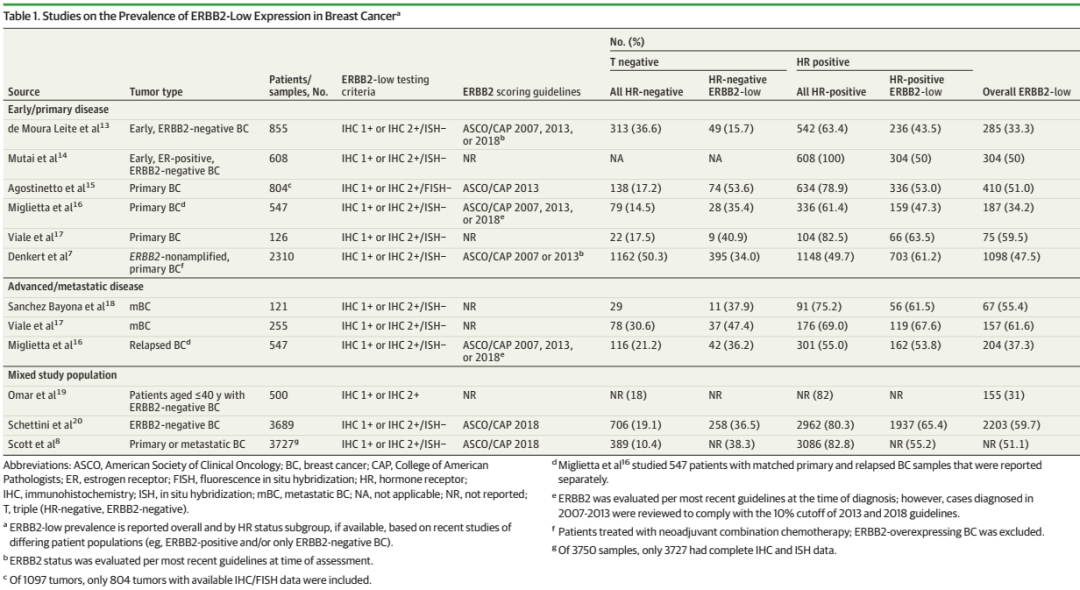
目前关于HER2-low预后意义的报道结果不一,例如一项纳入2310例HER2未扩增乳腺癌患者的研究表明,HER2-low相比HER2-0的病理学完全缓解(pCR)率更低(29.2%vs 39.0%;P=0.10),但3年无病生存(DFS)率更高(83.4%vs 76.1%;P=0.008)。亚组分析显示,尽管HR阳性乳腺癌中HER2-low的pCR率低于HER2-0组(17.5%vs 23.6%;P=0.024),但在HR阴性乳腺癌中确不是如此(50.1%vs 48.0%;P=0.21)。在DFS获益方面,HR阴性患者中HER2-low组的DFS相比HER2-0组显著更长(84.5%vs 74.4%;P=0.008),但HR阳性乳腺癌患者却无显著差异(82.8%vs 79.3%;P=0.39)。另外一项纳入了1304例HER2阴性晚期乳腺癌患者的研究中,HER2-low相比HER2-0组的OS无显著差异。而另一项纳入500例40岁及以下患者的研究中,尽管总体人群中HER2-low和HER2阴性组之间未观察到DFS或OS的差异,但在IHC亚组分析中,HER2 IHC 2+/ISH-组的DFS(63.5%)率显著低于HER2-0(70%)和HER2 IHC 1+(75%)乳腺癌组(p=0.04)。并且HER2 IHC 2+/ISH-组相比IHC-0组的OS更低(90%vs 96%,p=0.02)。
总的而言,这些研究显示,在考虑HER2-low对乳腺癌的预后时需要涉及到HR状态、HER2蛋白水平和基因组风险等与预后相关的因素,尽管不同的结论可能与研究间的不同的研究规模、随访时间、HER2-low的定义以及评分标准有关。此外,在传统定义的HER2阴性肿瘤中,HR表达是预后的主要生物学驱动因素之一,并且HER2表达与ER表达相关,这可能对预后分析造成干扰。未来的研究需要明确HER2-low独立于HR状态的预后意义。
表2.HER2-low乳腺癌预后相关研究
HER2-low乳腺癌
治疗药物的临床研究进展
尽管抗HER2药物并非专门开发用于治疗HER2-low乳腺癌,但是单克隆抗体、ADC药物和其他新型药物都在HER2-low乳腺癌治疗领域进行了积极探索。
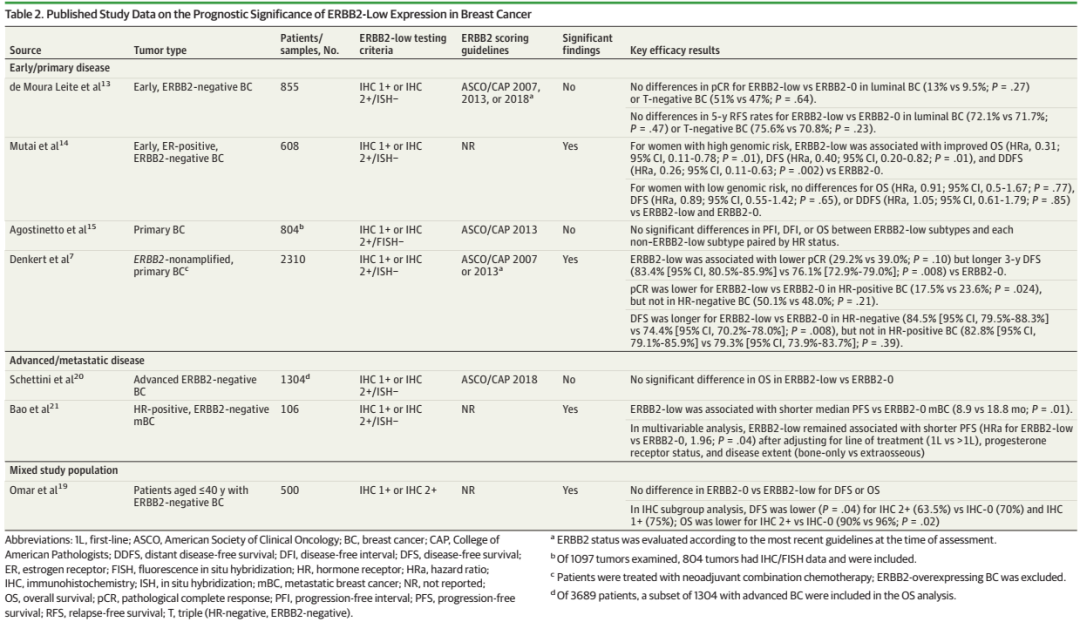
表3.抗HER2治疗药物在HER2-low乳腺癌中的临床研究进展
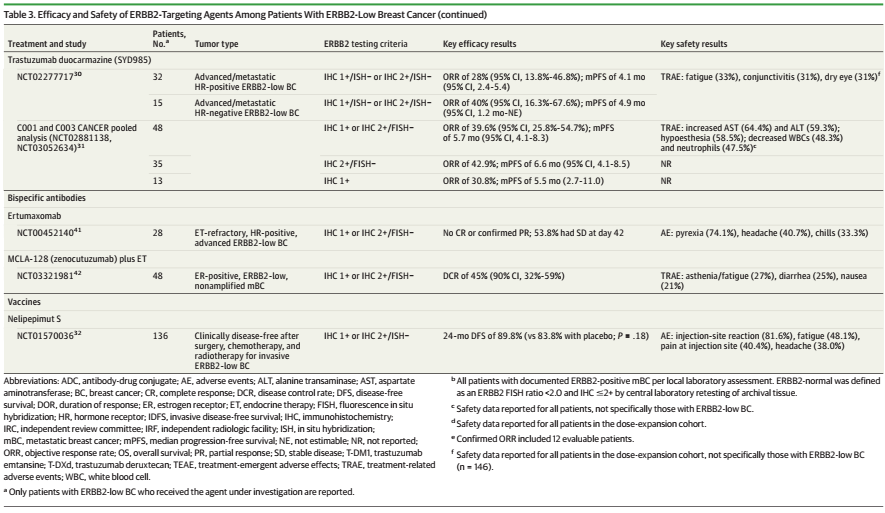
▌单克隆抗体
NSABP B-47研究纳入了IHC 1+、IHC 2+/ISH-或IHC 2+/HER2拷贝数lt;4.0的乳腺癌患者,结果表明在辅助化疗基础上增加曲妥珠单抗并不能改善患者的无侵袭性疾病生存期(IDFS)(5年IDFS率:化疗加曲妥珠单抗组为89.8%,单独化疗组为89.2%;P=0.85)。并且不同HER2 IHC表达水平、淋巴结受累或激素受体状态亚组同样没有观察到化疗联合曲妥珠单抗与单独化疗的显著差异。两组的5年OS率分别为94.8%和96.3%(p=0.15),增加曲妥珠单抗没有显示出额外获益。
一项II期临床试验旨在评估帕妥珠单抗在既往接受过治疗的传统意义上的HER2阴性乳腺癌(FISH−和IHC-0、1+或2+)中的疗效和安全性,但是该研究中观察到的疗效有限,疾病稳定(SD)的持续时间较短。
这些结果提示曲妥珠单抗和帕妥珠单抗在HER2-low乳腺癌中并未展现出明显疗效,而单克隆抗体Margetuximab在HER2-low乳腺癌中显示出一定的临床前活性,其在HER2-low乳腺癌中开展的II期临床试验正在开展中,疗效结果待定。
▌ADC药物
上一代ADC药物T-DM1在HER2-low乳腺癌中的疗效相比在HER2阳性乳腺癌中更差,这在TDM4258g和TDM4374g等临床试验中已经得到了证实。但是新型ADC药物却在HER2-low乳腺癌中显示出明显疗效,这可能与新型ADC药物的旁观者效应有关。
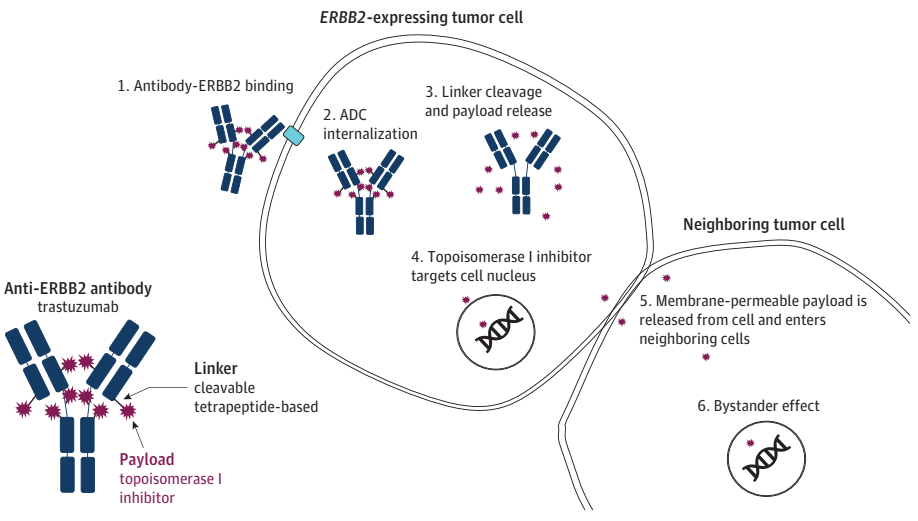
图1.T-DXd的作用机制
T-DXd是由曲妥珠单抗和拓扑异构酶I抑制剂通过一种基于四肽的可裂解连接子偶联而成,目前已经获批用于HER2阳性和HER2低表达晚期乳腺癌、HER2阳性胃或胃食管交界处腺癌,以及HER2突变非小细胞肺癌的适应症。在III期临床试验DESTINY-Breast04中,与医生选择的化疗(TPC)相比,T-DXd显著改善了晚期或转移性HER2-low乳腺癌(中位既往治疗线数为3)患者的中位无进展生存期(mPFS):总人群mPFS为9.9个月,HR阳性患者为10.1个月,HR阴性患者为8.5个月;亚组分析表明,IHC 1+和IHC 2+/ISH-肿瘤患者的mPFS没有明显差异。并且早在之前的1b期临床试验中,T-DXd在经过多线治疗(中位数,7.5线)的晚期或转移性HER2-low(IHC 1+/ISH-、IHC 1+/ISH未检测或IHC 2+/ISH-)乳腺癌患者中,获得了高达37%(54例患者中的20例)的确认的客观缓解率(ORR)。
此外,T-DXd与其他药物的联合治疗探索也正在积极进行中。例如在一项T-DXd+纳武利尤单抗的1b期试验中,39例既往接受过中位5线治疗的HER2-low乳腺癌患者的确认的ORR为37.5%(16例患者中的6例),疾病控制率(DCR)为75.0%,mPFS为6.3个月。在BEGONIA试验中,接受度伐利尤单抗+T-DXd一线治疗的12例可评价的HER2-low、HR阴性乳腺癌患者中,确认的ORR高达66.7%。
SYD985是一种由抗HER2抗体、可裂解连接子和载药Duocarmycin衍生物组成的新型ADC药物。基于SYD985开展的一项纳入标准治疗难治性乳腺癌患者(中位治疗线数:HR阳性HER2-low乳腺癌,7线;HR阴性HER2-low乳腺癌,4线)的临床研究中,32例HR阳性/HER2-low乳腺癌患者的ORR为28%,mPFS为4.1个月;15例HR阴性/HER2-low乳腺癌患者的ORR为40%,mPFS为4.9个月。
RC48也是一种HER2靶向的ADC药物,通过可裂解连接子将人源化lgG1 Hertuzumab和微管蛋白抑制剂MMAE偶联而成。目前在中国有条件获批用于HER2过表达的局部晚期或转移性胃癌患者(包括胃食管结合部腺癌)。在基于RC48的2项包含48例中国HER2-low乳腺癌患者的临床试验的汇总分析中,观察到ORR为39.6%,mPFS为5.7个月。在HER2 IHC 2+/FISH-(n=35)和HER2 IHC 1+(n=13)亚组中,ORR分别为42.9%和30.8%,mPFS则分别为6.6和5.5个月,这些数据提示其在HER2-low乳腺癌中的疗效与在HER2阳性乳腺癌中观察到的疗效相似。一项研究RC48治疗局部晚期或转移性HER2-low乳腺癌的III期试验正在进行中。其他诸如ARX788、A166、FS-1502等抗HER2 ADC药物也正在HER2-low乳腺癌治疗领域进行积极的探索之中。
值得一提的是,ADC药物除了在HER2-low乳腺癌中有明显获益之外,根据美国临床肿瘤学会和美国病理学会(ASCO/CAP)的HER2 IHC-0定义(无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色),ADC药物还可能针对部分HER2 IHC-0患者同样发挥疗效。在最近的一项II期临床试验中,接受T-DXd治疗的36例HER2-0乳腺癌患者中的11例(30.6%)观察到获得确认的最佳总体缓解。这些初步研究数据表明,在归类为HER2-0的一些肿瘤中仍存在部分HER2-low肿瘤,因而仍然表达一些能够和ADC药物相结合的靶点。此外,得益于ADC药物的旁观者效应,即便是HER2-low的肿瘤细胞也能够被在肿瘤细胞内部释放后的具有膜渗透性的游离载药杀伤。基于这些研究结果的发现,有必要重新评评估HER2-0的定义和/或HER2-low的阈值,这也是未来值得探索的重要方向。因为在其他大多数ADC药物的研究中,HER2-0患者并不能从治疗中获益,未来需要进一步阐明IHC-0 vs IHC 1+阈值的临床相关性,并且需要新的指南以识别可从HER2靶向ADC药物治疗中获益的患者。
▌其他药物
目前其他新型药物也在积极开发中,例如双特异性HER2或HER3靶向抗体Zenocutuzumab与内分泌治疗相比,在接受过多线既往治疗、内分泌治疗耐药的HER2-low转移性乳腺癌患者中显示出疗效优势,这可能与Zenocutuzumab能够克服HER3介导的耐药性有关。一项纳入HER2-low乳腺癌患者的IIb期临床试验中,HER2靶向疫苗nelipepimut-S与曲妥珠单抗联合用于佐剂治疗,但未观察到DFS获益。SAR443216是一款构建靶向HER2和T细胞的三特异性抗体,能同时靶向CD3/CD28/HER2,SAR443216在HER2-low异种移植模型中已经显示出临床前有效性。目前一项在HER2-low转移性乳腺癌模型中评估SAR443216治疗活性和安全性的I期临床试验正在进行中。
HER2-low乳腺癌
未满足的治疗需求
T-DXd在2022年8月5日获得FDA批准上市以前,一直没有针对HER2-low乳腺癌的标准治疗药物。在这之前,临床一直根据HER2阴性乳腺癌的现行标准治疗这类患者。对于HR阴性患者而言,采用针对TNBC的治疗方案,目前常用的一线治疗选择为化疗,但是化疗的毒性比较大,且对患者的生活质量造成不良影响。总体而言,TNBC的预后不容乐观,研究数据表明,TNBC患者一线治疗的中位OS为17.5个月,≥2线治疗的中位OS仅为8.1-15.2个月。
尽管TROP-2靶向ADC药物戈沙妥珠单抗(SG)对内分泌治疗耐药的HR阳性转移性乳腺癌也表现出一定疗效,但目前而言,HR阳性HER2-low晚期乳腺癌患者在CDK4/6抑制剂和内分泌治疗出现进展后的治疗选择非常有限。有研究显示,乳腺癌中ER和HER2信号通路之间存在交叉影响,而这与HER2过表达或HER2低表达,以及内分泌和CDK4/6抑制剂经治HR+/HER2-乳腺癌的不良预后相关。一项纳入HR+/HER2-晚期乳腺癌患者的回顾性研究表明,对于接受过内分泌治疗的luminal A型、luminal B型、HER2过表达、基底细胞样型乳腺癌患者(n=412),其中位OS分别为54.6、44.9、29.4和21.2个月;对于接受过内分泌治疗+瑞博西利的luminal A型、luminal B型、HER2过表达、基底细胞样型乳腺癌患者(n=585),其中位OS分别为68.0、58.8、40.3和19.4个月。在一项纳入106例接受过CDK4/6抑制剂和来曲唑或氟维司群治疗的转移性乳腺癌患者的研究中,HER2-low(IHC 1+或IHC 2+/ISH-)患者的mPFS显著短于HER2 IHC-0患者。在内分泌和CDK4/6抑制剂治疗耐药仍是临床面临的一大难题的情况下,对于约占HR+/HER2-转移性乳腺癌65%的HER2低表达患者,HER2提供了一个极具前景的替代治疗靶点。
▌评估和诊断
包括ASCO/CAP、NCCN和ESMO等相关指南均推荐所有新诊断或复发性乳腺癌患者应接受HER2状态检测,使用IHC评估HER2蛋白表达,在IHC检测结果不明确(即IHC 2+)的情况下,进行ISH以评估HER2基因扩增。但事实上,判读标准和最终结果在不断的变化。
目前的指南并没有针对HER2-low区分的详细描述,但是ASCO/CAP指南中对ER低阳性评分的表述从某种程度上支持了相关蛋白水平中等表达水平的概念。在现有文献和正在进行的研究中,如果IHC显示在超过10%的细胞中观察到一定水平的HER2表达,那么通常被定义为HER2-low,这与ASCO/CAP标准中的IHC 2+/ISH-或者IHC 1+(ISH的状态可能未知)相一致。
美国FDA批准的IHC检测方法包括HercepTest和VENTANA 4B5。最近的一项研究对检测方法进行了比较,发现这两种检测方法相对一致,在73.2%(95%CI,69.1%-77.0%)的样本中分类一致。使用VENTANA 4B5被归类为HER2-low的肿瘤多于HercepTest。
HER2表达在单个肿瘤和转移病灶间可能具有异质性,并且这种异质性可能具有不同的模式,可能是成簇、镶嵌或分散模式。尽管需要研究进一步阐明HER2表达异质性在HER2-low乳腺癌生存结局中的相关性,但最近的一项研究使用基于深度学习为基础的图像分析来评估151例患者中的HER2表达状态,结果表明HER2异质性是决定HER2-low患者对T-DXd治疗反应的一个重要因素。但是当前HER2检测报告缺乏这方面的细节,只是简单将HER2状态报告为阴性、阳性或者不明确,这并不能很好的识别可从潜在治疗中获益的HER2低表达人群。为了更加详细的报告HER2状态,需要采用新的检测报告方法。
当前技术的局限性
▌检测方式
目前的技术主要是为了确定HER2阳性状态,而不是为了区分HER2-low或者HER2不表达,对HER2-low的检测可能产生不准确和不一致的结果,因而需要更加可靠的方法来量化HER2表达。作为一种半定量检测方法,IHC的灵敏度可能不足以检测极低水平的HER2蛋白。此外,IHC结果可能因样本质量、样本采集和固定之间的时间、组织固定的方法和质量、抗原修复和染色方法、分析因素以及样本判读而异。其他检测HER2状态的方法也可能产生不同的结果,这主要取决于检测样本材料的不同。根据ASCO/CAP的建议,目前认为ISH联合IHC分析是评估不明确HER2状态的标准方式。
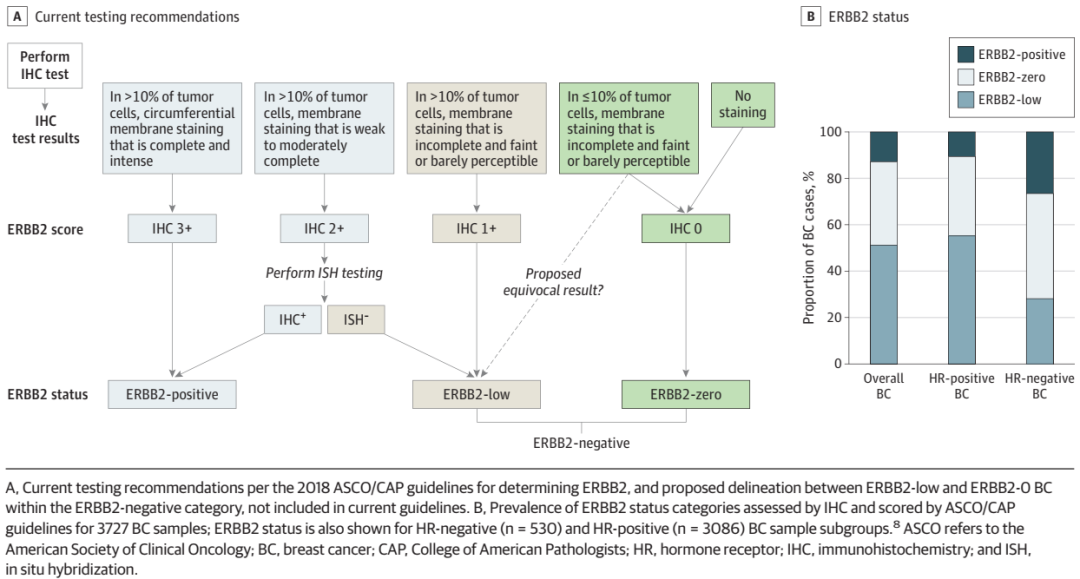
图2.当前的HER2检测方式
▌评分和判读
目前区分IHC-0和1+的10%的临界值可能存在的一个根本问题,是它的设置最初是为了识别适合接受曲妥珠单抗治疗的HER2阳性乳腺癌患者,而对于HER2-low状态的判读,没有数据支持这一阈值,需要开展进一步研究以明确HER2-low的阈值。在IHC-0和IHC 1+之间设置一个临界值,通过明确的方法进行准确定义,可能有助于区分HER2-low和HER2 IHC-0。值得注意的是,正在进行的DESTINY-Breast06临床试验,旨在评估HER2表达介于0和1+之间的乳腺癌患者接受T-DXd的疗效和安全性,可能会为HER2-low阈值的确定提供证据。
另外,减少不同判读者之间的差异,对于区分IHC-0和IHC 1+尤其重要,但由于尚未定义详细和严格的标准,这在当前难以做到。不同研究中观察到不同HER2状态的IHC检测在当地和中心实验室检测之间的一致率为15%-86%。尽管在一项研究中仅允许有相应资质的当地实验室进行检测后的一致性得到改善。但在评估各实验室HER2 IHC评分一致性的最大的一项研究中,涵盖约1391-1452个实验室中共计80个组织芯的IHC评分结果,观察到IHC-0和1+之间的一致性最差。
未来方向
目前已经在探索新的方法以定量评估HER2表达状态,例如HERmark(Monogram Biosciences)、Oncotype DX(EXACT Sciences Corporation)和TargetPrint(Agendia Incorporated),并用于评估HER2表达乳腺癌的长期预后和获得pCR的可能性(HER2DX[Reveal Genomics])。HER2 mRNA表达水平也可能有助于评估在HER2-low环境中,ADC药物对患者的治疗获益。在HER2阳性转移性乳腺癌患者中,观察到较高的HER2 mRNA水平与T-DM1更好的PFS改善和更高的pCR率相关。尽管ISH与IHC检测相结合可能有助于识别一些HER2-low病例,但评估HER2蛋白表达的更多定量方法可能实现更好地识别HER2-low状态。例如质谱分析已显示出评估HER2状态的前景,多反应监测实验可产生比IHC更准确的结果,并且可以区分IHC无法区分的HER2表达不明确的亚组。数字成像和计算病理学方法(即机器学习)也可以帮助区分HER2-low和HER2-0。这些技术可能比人类评分更准确,并且在可能通过对样本中的每个细胞进行评分方面具有优势。
为了制定关于HER2-low检测和评分最佳实践的指南,需要开展进一步的研究,包括HER2-low人群中探索新型HER2靶向药物在不同HER2表达模式和水平的疗效。需要能够量化HER2表达异质性的技术,并进一步鉴定可有效治疗同质性和/或异质性表达HER2-low的肿瘤的药物。
结
论
尽管目前的信息不支持将HER2-low归类为一种独立的乳腺癌生物学亚型,但越来越多的研究证据表明,HER2-low可能是一种临床治疗相关的分型,并且其检测和治疗格局都在发生变化。近期DESTINY-Breast04研究的结果证实HER2-low能够作为乳腺癌一种新的临床治疗分型,并且其他药物也正在开展相关临床研究。未来的探索还需要确定HER2检测和评分的最佳实践,以筛选识别出在HER2-low中能从HER2靶向治疗中获益的患者。
参考文献:
[1]Prat A,Bardia A,Curigliano G,et al.An Overview of Clinical Development of Agents for Metastatic or Advanced Breast Cancer Without HER2 Amplification(HER2-Low).JAMA Oncol.Published online September 15,2022.
*此文仅用于向医学人士提供科学信息,不代表本平台观点

| 留言与评论(共有 0 条评论) “” |