*仅供医学专业人士阅读参考
新型ADC广泛覆盖HER2阳性/HER2低表达乳腺癌伴活动性或稳定性脑转移以及软脑膜转移获益人群,未来前景广阔。
乳腺癌脑转移至今仍是临床上面临的一大治疗难题,近年来,随着新型抗肿瘤药物不断涌现,研究者针对乳腺癌脑转移也进行了诸多探索。一年一度的SABCS大会于2022年12月10日完美落幕,本次大会一如既往公布了乳腺癌领域的突破性、前沿研究进展,其中新型ADC药物T-DXd携多项重磅研究成果精彩亮相,包括在乳腺癌脑转移治疗领域,也有多个研究披露最新数据。如DEBBRAH研究和ROSET-BM研究成果均备受领域学者重点关注,另外,正在开展之中的DESTINY-Breast12研究同样引人注目。基于这些背景,医学界肿瘤频道特邀解放军总医院第五医学中心王涛教授针对相关研究进展进行详细解读,并阐述其对于临床实践的重要价值。
DEBBRAH研究在HER2阳性和HER2低表达晚期乳腺癌伴稳定性、活动性或脑膜转移患者中探索了T-DXd的治疗潜力,该研究于2021年SABCS大会首次公布结果,随后又正式发表于《Neuro-Oncology》,本次再度亮相于2022年SABCS大会,首先请您分享一下相关研究成果,并发表您对该研究意义的看法?
王涛教授:脑转移是乳腺癌诊疗中备受关注的重要话题,并且近年来,随着乳腺癌诊疗水平的提高,患者生存时间得以延长,随之而来观察到更多患者病程进展至脑转移阶段,从而导致了脑转移发生率的提高。HER2阳性乳腺癌和三阴性乳腺癌(TNBC)脑转移发生率相比HR阳性乳腺癌更高,HER2低表达约占总体乳腺癌的45%-55%[1],其中包括了相当一部分传统定义的TNBC和HR阳性乳腺癌群体,并且有研究表明,HER2低表达相比HER2阴性乳腺癌患者更容易发生脑转移[2]。
DEBBRAH是一项针对脑转移患者的国际多中心、5个队列、II期临床试验,纳入的脑转移患者群体十分广泛,涵盖了HER2阳性、HER2低表达乳腺癌中的几乎所有的脑转移类型。5个队列共入组39例年龄≥18岁、既往接受过针对HER2阳性或HER2低表达晚期乳腺癌治疗的稳定性、进展或未治疗的BM和/或 LMC患者:队列1:HER2阳性晚期乳腺癌伴放疗和/或手术后脑转移未进展的患者;队列2:HER2阳性或HER2低表达晚期乳腺癌伴无症状未治疗脑转移的患者;队列3:HER2阳性晚期乳腺癌伴局部治疗后脑转移进展患者;队列4:HER2低表达晚期乳腺癌伴局部治疗后脑转移进展患者;队列5:HER2阳性或HER2低表达晚期乳腺癌伴LMC。患者接受5.4 mg/kg T-DXd静脉给药,每21天一次,直至疾病进展、出现不可耐受的毒性或撤回知情同意。其中队列1的主要终点为16周的无进展生存(PFS)率,队列2、队列3、队列4的主要终点是研究者采用 RANO-BM标准评估的颅内客观缓解率 (ORR)。
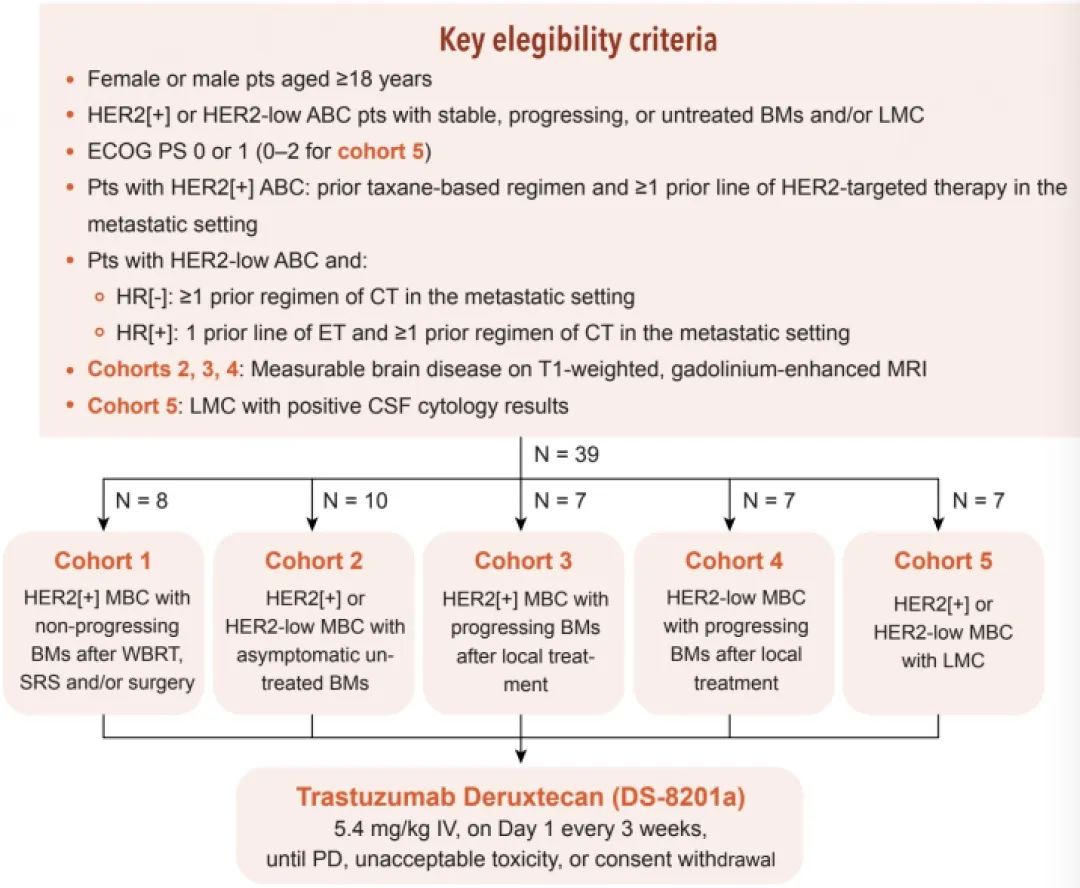
图1. DEBBRAH研究设计
2022年5月26日,美国《Neuro-Oncology》在线发表DEBBRAH试验研究结果,报告了队列1(n=8)、队列2(n=4)、队列3(n=9)中HER2阳性晚期乳腺癌脑转移患者的研究数据。结果显示[3]:
队列1达到主要终点,16周的PFS率为87.5%。数据截止时,共3例(37.5%)患者为PD(1例为颅内,2例为颅外)。
队列2中,2例达到颅内PR(颅内ORR为50%),没有患者出现颅内PD。
队列3中,4例获得颅内PR(44.4%),达到主要终点(颅内ORR为44.4%)。
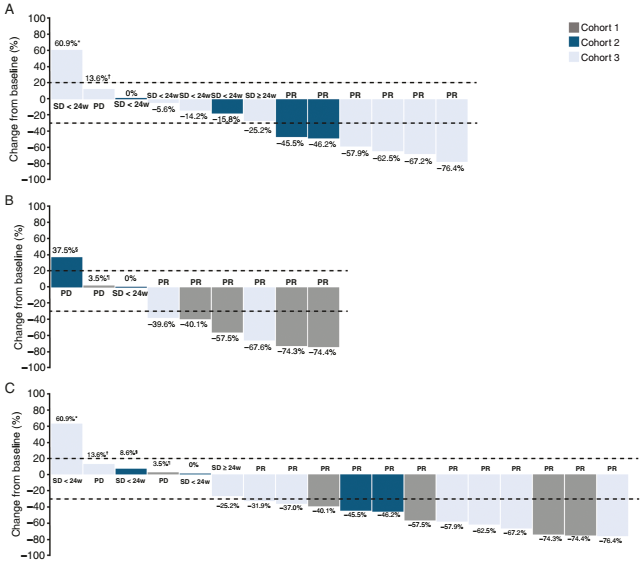
图2. 队列1-3中HER2阳性乳腺癌患者的疾病缓解情况
2022年SABCS大会公布了队列2和队列4中HER2低表达乳腺癌脑转移患者的研究数据。结果显示[4]:
队列2:颅内ORR为66.7%(6例患者中的4例达到颅内PR);SD≥24w的患者比例为16.7%;颅内CBR为83.3%;颅内DOR为3.6个月。
队列4:颅内ORR为33.3%(6例患者中的2例达到颅内PR);SD≥24w的患者比例为16.7%;颅内CBR为50%;颅内DOR为7.8个月。
队列2和队列4总体患者的颅内ORR(6/12)为50%。
在数据截止时,队列2中0例患者、队列4中3例 (50.0%) 患者仍在继续接受T-DXd治疗。
将队列2和队列4中具有可测量颅内或颅外疾病的患者合并后,ORR、CBR和中位DOR 分别为41.7%、50.0%和5.5个月,中位PFS为5.67个月。
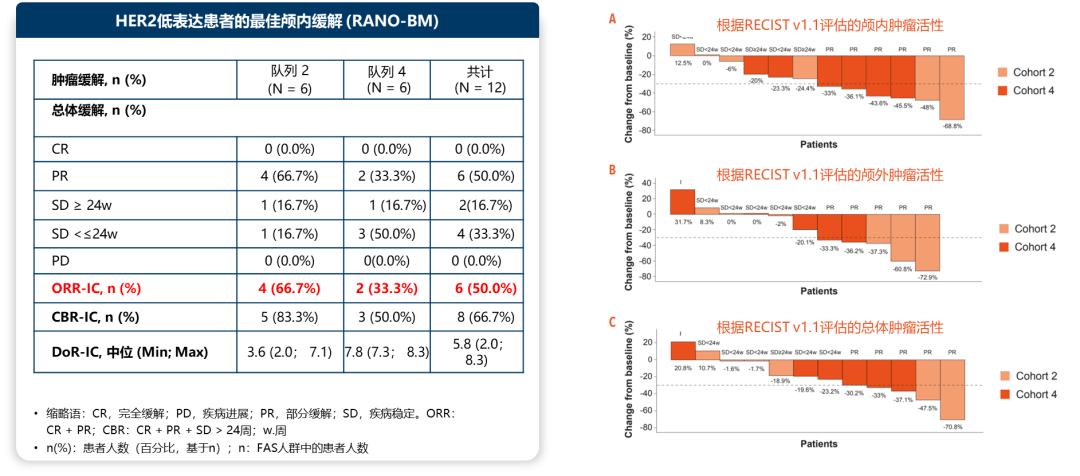
图3. 队列2、4中HER2低表达乳腺癌患者的疾病缓解情况
DEBBRAH研究是首个同时在HER2阳性和HER2低表达乳腺癌脑转移患者中探索T-DXd疗效与安全性的临床试验。尽管入组患者人数并不多,但是凭借着在HER2阳性乳腺癌脑转移患者中的突破性治疗获益,其研究数据发表于国际权威期刊,充分肯定了T-DXd在HER2阳性乳腺癌脑转移患者中的巨大治疗价值。目前临床上针对HER2低表达乳腺癌脑转移,尚缺乏足够的临床证据,2022年SABCS大会公布的DEBBRAH研究结果表明,T-DXd在既往接受过治疗的HER2低表达伴未经治疗的无症状脑转移或在局部治疗后进展的脑转移晚期乳腺癌患者中展现出令人鼓舞的抗肿瘤活性,这对于临床而言是具有开拓性意义的研究进展,可以说为HER2低表达乳腺癌脑转移治疗领域的探索“打了一剂强心针”。总体而言,DEBBRAH研究涵盖了临床上常见的大多数乳腺癌脑转移人群,并且证实T-DXd能为这类患者带来显著的颅内控制效果。但目前而言,该研究病例数相对有限,未来还需要扩大样本量,进一步验证T-DXd的确切疗效。
在HER2阳性乳腺癌脑转移治疗领域,不管是稳定性脑转移还是活动性脑转移都积累了较为丰富的证据,但是对于软脑膜转移患者,目前的治疗选择相对有限,2022年SABCS大会公布了ROSET-BM研究成果,或为相关领域增加新的循证,能否请您分享该研究成果,并谈谈您对该研究意义的看法?
王涛教授:大约20%-50%的HER2阳性转移性乳腺癌患者会发生脑转移,并且12%-43%的转移性乳腺癌患者会发生软脑膜转移(LMC),患者一旦发生脑转移或者LMC,其预后较差,生活质量显著下降[5]。尤其LMC,往往意味着患者生命的倒计时。临床上多采用放疗,但是效果一般。另外可以采用鞘内注射甲氨蝶呤,但是仅治疗初期效果良好,总体疗效的维持时间比较短,并且还可能存在脱髓鞘改变的不良反应。因而指南针对这两种治疗手段的推荐级别较弱。截至目前,临床上针对LMC仍存在较大未被满足的治疗需求。
ROSET-BM是一项多中心、回顾性病历研究,纳入2020年05月25日至2021年04月30日期间在标准治疗基础上接受T-DXd治疗的HER2阳性转移性乳腺癌伴脑转移和LMC患者。在总分析人群中,由研究者评估其ORR、PFS和OS。此外,在具有脑部影像数据的患者(脑成像人群)中,由独立影像科医师根据RECIST v1.1评估颅内ORR和颅内PFS[5]。
在研究期间,共62家研究中心参与,最后104例患者被纳入分析:
70.2%(n=73)为活动性脑转移不伴LMC;
16.3%(n=17)为活动性脑转移伴LMC;
5.8%(n=6)为稳定性脑转移;
1.9%(n=2)仅为LMC;
5.8%(n=6)未分类。
在30.8%(n=32)的患者中观察到症状性脑转移。中位既往治疗线数为4(范围:1-15)。
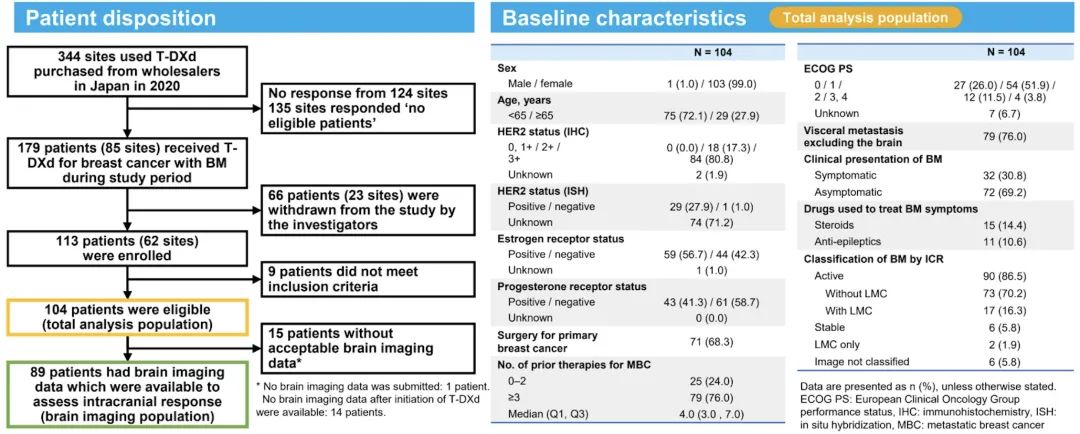
图4. 研究入组患者筛选流程及基线特征
T-DXd首次治疗后的中位随访时间为11.2个月,在104例总分析人群中:中位PFS为16.1个月,中位OS未达到。中位治疗失败的时间(TTF)为9.7个月。
其中按照脑转移分层的生存获益方面:
活动性脑转移患者的中位PFS为13.4个月,中位OS未达到;
稳定性脑转移患者的中位PFS为14.6个月,中位OS未达到;
LMC患者的中位PFS和OS均未达到。
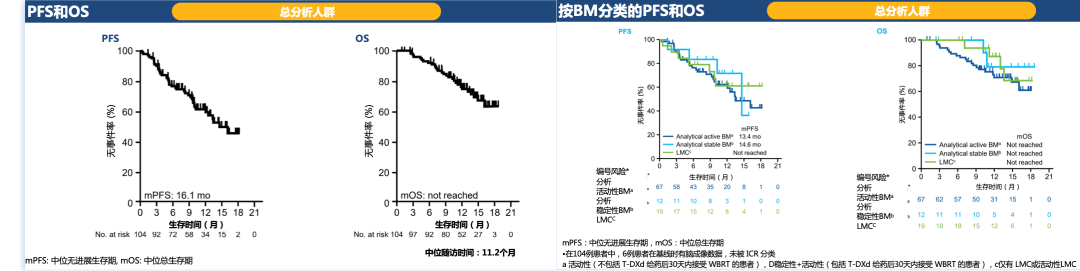
图5. 总分析人群及其按照脑转移分层的治疗获益
在89例脑成像人群中:颅内ORR为62.7%(CR率为0.0%;PR率为62.7%),5.9%的患者观察到了颅内PD,6个月的颅内CBR为70.6%,中位颅内PFS为16.1个月。
其中按照脑转移分层的生存获益方面:
活动性脑转移患者的颅内ORR为54.1%,6个月的颅内CBR为62.2%,中位颅内PFS为16.1个月;
稳定性脑转移患者的颅内ORR为100%,6个月的颅内CBR为100%,中位颅内PFS未达到;
LMC患者的颅内ORR为77.8%,6个月的颅内CBR为88.9%,中位颅内PFS为12.2个月。

图6. 脑成像人群及其按照脑转移分层的治疗获益
研究结果显示,T-DXd在伴有稳定性、活动性脑转移以及LMC的HER2阳性转移性乳腺癌患者中均具有良好获益,为这类患者获得疾病深度缓解和更长生存时间创造了机会。尤其对于LMC患者,其颅内ORR高达77.8%,疗效出乎意料,为临床上针对LMC的治疗探索增加了莫大的信心,未来T-DXd或将成为针对HER2阳性乳腺癌伴LMC的重要治疗选择。此外,尽管该研究为回顾性病历分析,但其入组患者人数较多,可以作为T-DXd治疗乳腺癌脑转移的其他样本量较小的前瞻性临床试验的良好补充。总体而言,该研究成果对于改变临床实践具有重要意义。
除了上述研究之外,T-DXd在乳腺癌脑转移治疗领域还进行了其他探索,其中就包括DESTINY-Breast12研究,尽管目前尚未公布研究成果,但是该研究不仅评估了T-DXd治疗乳腺癌脑转移的效果,同时还有望为乳腺癌脑转移的预防性探索提供依据,请分享相关研究内容,并发表您对于该研究意义的看法。
王涛教授:刚才提到的DEBBRAH是一项小样本的前瞻性、II期临床试验,ROSET-BM则是一项大样本的回顾性分析,而相比之下,DESTINY-Breast12研究则是一项更高站位的大样本、前瞻性临床试验。在这项开放性、国际多中心、IIIb/IV期研究中,纳入既往接受过治疗的伴或不伴脑转移的HER2阳性晚期乳腺癌患者,这些患者在既往基于抗HER2的治疗方案中发生进展,且在转移阶段接受不超过二线治疗(不包括图卡替尼)。根据患者基线时是否存在脑转移,约500例合格受试者分别入组2个队列:队列1包括250例基线时无脑转移的受试者,队列2包括250例基线时有脑转移的受试者(包括稳定性和活动性脑转移)。队列1的主要终点为RECIST v1.1评价的ORR;队列2的主要终点为RECIST v1.1评价的PFS[6]。
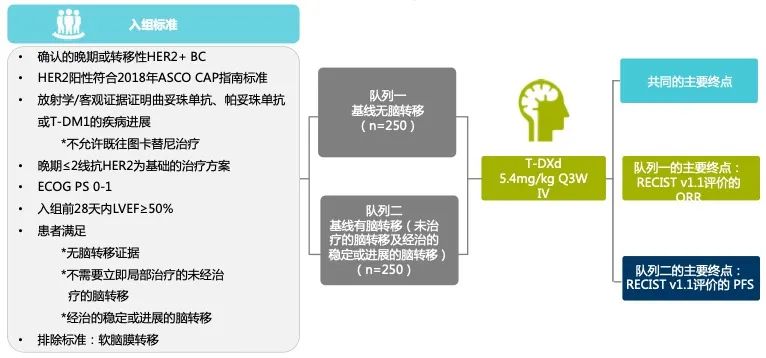
图7. DESTINY-Breast12研究设计
目前T-DXd在HER2阳性乳腺癌脑转移治疗领域已经进行了诸多探索,并且包括在稳定性脑转移、活动性脑转移中都显示出良好获益。但客观来看,尽管T-DXd在稳定性脑转移患者中的疗效值得肯定,取得了迄今为止最长的中位PFS(15个月)[7],但其在活动性脑转移患者中的数据相对有限,且目前多为小样本研究。DESTINY-Breast12是一项专门探索了T-DXd在HER2阳性乳腺癌脑转移患者中疗效与安全性的大样本IIIb/IV期临床研究,研究成果或将进一步验证T-DXd对HER2阳性乳腺癌脑转移患者的治疗价值,同时更加丰富新型ADC药物在乳腺癌脑转移治疗研究探索中的循证证据。
近年来,药物是否能够预防或延迟脑转移的发生,同样成为临床关注热点。尽管有研究表明小分子TKI可能在乳腺癌脑转移预防中起到一定的积极作用,但是大分子药物的预防效果还有待明确,DESTINY-Breast12研究同时还评估了T-DXd在基线不伴脑转移HER2阳性晚期乳腺癌患者中的治疗获益,如果研究结果证实T-DXd能够有效延迟CNS的发生时间,并降低疾病进展至CNS的发生率,或能为大分子药物在乳腺癌脑转移预防方面的作用增加有力循证。
既往之所以认为乳腺癌脑转移的治疗效果差,原因之一在于很多药物分子无法透过血脑屏障,ADC药物从结构上看是单克隆抗体和细胞毒药物的偶联物,作为典型的大分子药物,新型ADC药物T-DXd却能对乳腺癌脑转移患者发挥较好的疗效,其中的可能原因有哪些?
王涛教授:目前多项临床研究共同证实T-DXd在乳腺癌脑转移中的应用价值,并且极大程度颠覆了大分子药物对脑转移治疗效果不佳的传统认知。正常情况下血脑屏障 (BBB)对于大脑能起到很好的保护作用,可以防止一些大分子或者有毒物质入脑危害中枢神经系统。但是任何事物都是一把“双刃剑”,当脑转移患者接受全身药物治疗时,BBB的存在反而起到了反作用,既往已经有多项研究表明脑转移患者的药物治疗效果差与其无法透过BBB相关。
然而事实上,脑转移在发生过程中,BBB的完整性已经被破坏掉[8]。并且全脑放疗对BBB的病理影响,也可能会增加药物分子的通透性。例如有研究表明,接受曲妥珠单抗治疗的HER2阳性乳腺癌脑转移患者,在接受全脑放疗(WBRT)前,血液和脑脊液中曲妥珠单抗的浓度比为 420:1,而在接受WBRT之后,血液和脑脊液中曲妥珠单抗的浓度比则为76:1,即患者在放疗后脑脊液中曲妥珠单抗的浓度明显升高[9]。这些相关机制都为大分子药物用于乳腺癌脑转移提供了重要的理论基础。
既往包括大分子单克隆抗体、二代ADC药物T-DM1均在HER2阳性乳腺癌脑转移中进行了探索,例如II期PATRICIA研究[10]评估了患者接受帕妥珠单抗(840mg负荷剂量,此后每3周420mg)和高剂量曲妥珠单抗(6mg/kg每周一次)治疗,直至CNS或全身疾病进展或出现无法耐受的毒性反应。根据RANO-BM评估,颅内ORR仅为11%,中位缓解持续时间(DOR)为4.6个月。T-DM1关键Ⅲ期EMILIA研究的探索性分析表明[11],按照RECIST v1.0评估,T-DM1相比拉帕替尼+卡培他滨治疗组的中位PFS并无统计学差异(5.9个月 vs. 5.7个月,p=1.000),而T-DM1的中位OS更优(26.8个月 vs. 12.9个月,p=0.0081)。T-DM1的另一项大型Ⅲ期KAMILLA研究中[12],脑转移总人群的中位PFS为5.5个月,中位OS为18.9个月(RECIST v1.0)。尽管进行了诸多尝试,但是乳腺癌脑转移治疗标准并未因此确立,提示这些大分子药物在脑转移中的疗效仍有待提升。同时,这些大分子药物的早期研究进展也为后续T-DXd在乳腺癌脑转移中的进一步探索提示了重要方向。
最值得一提的是,T-DXd在脑转移中的突破性治疗获益与其独特的结构和机制密切相关。T-DXd采用基于四肽的可裂解连接子,仅被肿瘤细胞高表达的溶酶体蛋白酶特异性识别和切割,因而在血液循环中高度稳定,脱靶毒性极低。并且该连接子具有较低的疏水性,有利于改善整体ADC药物的亲水性。当单个抗体同时偶联8个载药(DAR为8)时也不容易发生聚集而被排除体外,高达8的DAR值大大增强抗肿瘤效力。并且高活性载药DXd,不仅机制独特,能避免与临床常用化疗药物发生交叉耐药。还能跨膜进入邻近肿瘤细胞,发挥强效旁观者效应,从而杀伤更多肿瘤细胞[13-15]。这些独特属性都赋予了T-DXd在乳腺癌脑转移治疗中的巨大优势。未来T-DXd在乳腺癌脑转移中还有非常广阔的探索空间,期待随着更多研究数据的披露,T-DXd能带给临床上更多惊喜。
专家简介

王涛 教授
医学博士 主任医师 副教授 硕士研究生导师解放军总医院第五医学中心乳腺肿瘤科 副主任CSCO神经系统肿瘤专委会 副主任委员CSCO乳腺疾病专家委员会 委员北京乳腺病防治学会青委会 副主任委员中国抗癌协会乳腺病专业委员会 委员
参考文献:
[1].Tarantino P, Hamilton E, Tolaney SM, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020 Jun 10;38(17):1951-1962.
[2].Guven DC, Kaya MB, Fedai B, et al. HER2-low breast cancer could be associated with an increased risk of brain metastasis. Int J Clin Oncol. 2022 Feb;27(2):332-339.
[3].Pérez-García JM, Batista MV, Cortez P, et al. Trastuzumab Deruxtecan in Patients with Central Nervous System Involvement from HER2-Positive Breast Cancer: The DEBBRAH Trial. Neuro Oncol. 2022 May 26:noac144.
[4].Pérez-García JM, Batista MV, Cortez P,et al.Trastuzumab Deruxtecan in patients with Active Central Nervous System Involvement from HER2-Low Advanced Breast Cancer: The DEBBRAH Trial.2022 SABCS. PD7-02.
[5].Yamanaka T,Nikura N, Nomura H, et al.Trastuzumab deruxtecan for the treatment of patients with HER2-positive breast cancer with brain and/or leptomeningeal metastases: A multicenter retrospective study (ROSET-BM study). 2022 SABCS.PD7-01.
[6].Lin NU,Ciruelos E,Jerusalem G,et al.Open-label,multinational, multicenter, phase 3b/4 study of trastuzumab deruxtecan (T-DXd) in patients with or without baseline brain metastasis with previously treated advanced/metastatic human epidermal growth factor receptor 2–positive breast cancer: DESTINY-Breast12.2021 ESMO.335TiP.
[7].Hurvitz S,Kim SB,Chung WP,et al.Trastuzumab Deruxtecan (T-DXd) vs Trastuzumab Emtansine (T-DM1) in Patients (Pts) With HER2+ Metastatic Breast Cancer : Subgroup analyses from the Randomized Phase 3 DESTINY-Breast03 Study.2021 SABCS.GS3-01.
[8].Keith KC, Lee Y, Ewend MG, et al. Activity of trastuzumab- emtansin (T-DM1) in HER2- positive breast cancer brain metastases: a case series. Cancer Treat Commun,2016, 7: 43-46.
[9].Stemmler H,Schmitt MA,Bernhard H,et al.Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier.Anti-cancer Drugs,2007,18(1):23-28.
[10].Lin NU, Pegram M, Sahebjam S, et al. Pertuzumab Plus High-Dose Trastuzumab in Patients With Progressive Brain Metastases and HER2-Positive Metastatic Breast Cancer: Primary Analysis of a Phase II Study. J Clin Oncol. 2021 Aug 20;39(24):2667-2675.
[11].Krop IE, Lin NU, Blackwell K, et al. Trastuzumab emtansine (T-DM1) versus lapatinib plus capecitabine in patients with HER2-positive metastatic breast cancer and central nervous system metastases: a retrospective, exploratory analysis in EMILIA. Ann Oncol. 2015 Jan;26(1):113-119.
[12].Montemurro F, Delaloge S, Barrios CH, et al. Trastuzumab emtansine (T-DM1) in patients with HER2-positive metastatic breast cancer and brain metastases: exploratory final analysis of cohort 1 from KAMILLA, a single-arm phase IIIb clinical trial. Ann Oncol. 2020 Oct;31(10):1350-1358.
[13].Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, A Novel HER2-Targeting ADC with a Novel DNA Topoisomerase I Inhibitor, Demonstrates a Promising Antitumor Efficacy with Differentiation from T-DM1. Clin Cancer Res. 2016 Oct 15;22(20):5097-5108.
[14].Nakada T, Masuda T, Naito H, et al. Novel antibody drug conjugates containing exatecan derivative-based cytotoxic payloads. Bioorg Med Chem Lett. 2016 Mar 15;26(6):1542-1545.
[15].Nakada T, Sugihara K, Jikoh T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |