
撰文 | Qi
胰腺是由外分泌和内分泌部组成的器官,前者包含分泌消化液的腺泡和导管细胞,而后者包含α、β、δ、ε和胰腺多肽细胞,它们共同调节葡萄糖稳态,其功能障碍会导致胰腺炎、胰腺癌和糖尿病的发生。显而易见,了解胰腺发育轨迹有助于量产β细胞以提供治疗机会,尽管近年来大量工作着手于1型糖尿病细胞干细胞替代疗法,但确定的分化策略仅限于小鼠中,由于物种差异,人类胰岛发育时间跨度长,因而还未能在体外重复产生具有原代人类胰岛属性且功能齐全的β细胞【1-3】。此外,虽然一些工作成功开发了能产生β细胞的干细胞方法【4-6】,但干细胞衍生的细胞在代谢上与成人胰岛不同,因此,通过深入分析发育中的人类胰腺获得的对人类胰腺内分泌发生的图谱能为优化这一策略提供见解。
2022年12月12日,来自伦敦国王学院的Shanta J. Persaud团队在Cell Metabolism杂志上发表了一篇题为 Single-cell transcriptomic and spatial landscapes of the developing human pancreas 的文章,他们通过对受孕后8至20周多个发育阶段的人类胎儿胰腺进行单细胞和空间转录组学分析整合,确定了调节祖细胞分化的新候选基因,并首次确定雪旺细胞和间充质细胞在人类内分泌祖细胞和腺泡细胞分化中的潜在重要性。

研究人员首先将scRNA-seq与10x Visium空间转录组学相结合,应用于来自12个个体、涵盖7个发育时间点的胚胎,系统地描述人类胰腺的发育情况。在原位识别α、β、δ、内分泌祖细胞、腺泡细胞等细胞后,利用深度学习方法以可视化每个空间体素内的细胞组成,并预测每个发育阶段的细胞比例。结果显示,在研究的所有发育阶段,免疫细胞与间充质细胞和内皮细胞在空间上共置,但与内分泌细胞不共置,而Schwann细胞在15孕后周(PCW)时与间充质细胞和内分泌祖细胞在空间上非常接近。在众多细胞类型中,作者重点关注了内分泌细胞的基因表达轨迹,借助于差异表达基因和典型标记,鉴定了不同的内分泌细胞群,例如祖细胞群 (NEUROG3+)、β细胞 (INS+)、δ细胞 (SST+)、α细胞 (GCG+)、胰多肽细胞 (PPY+) 和 ε细胞 (GHRL+)。轨迹分析揭示了早期内分泌祖细胞可分化α和β细胞谱系,除了上述已知标记外,还鉴定了新的分支特异性基因,例如α分支的TSMB10、TENT5A和ANXA2,以及β分支的MEG3、ASB9和转录因子MEIS2。
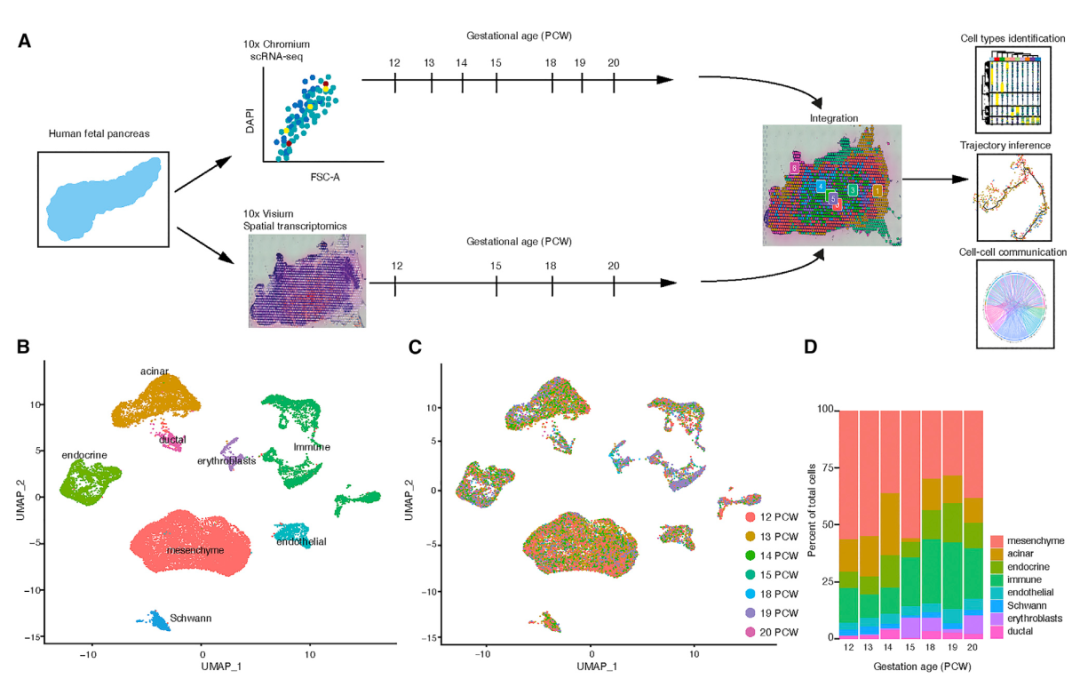
图1. 发育中的人类胰腺的单细胞测序
在确定了内分泌簇的谱系动力学之后,作者随即研究了非内分泌细胞对内分泌的贡献。由于Schwann细胞在空间上与内分泌祖细胞同定位于15 PCW,提示它们之间的细胞间通讯可能有助于内分泌细胞分化。通过对scRNA-seq数据的分析,作者确定了Schwann和内分泌祖细胞之间的多个配体-受体对,根据得分,专注于L1细胞粘附分子(L1CAM)-肝配蛋白B2(EPHB2)相互作用,将两者的表达映射到空间转录组数据上发现L1CAM-EPHB2 相互作用在两种细胞的交界面,利用单分子荧光原位杂交(smFISH)也确定了15 PCW连续切片中GAP43+ Schwann细胞与NEUROG3内分泌祖细胞的紧密接近,但仍需进一步的工作来确定是否是通过L1CAM-EPHB2通路来完成β细胞的特化和成熟。
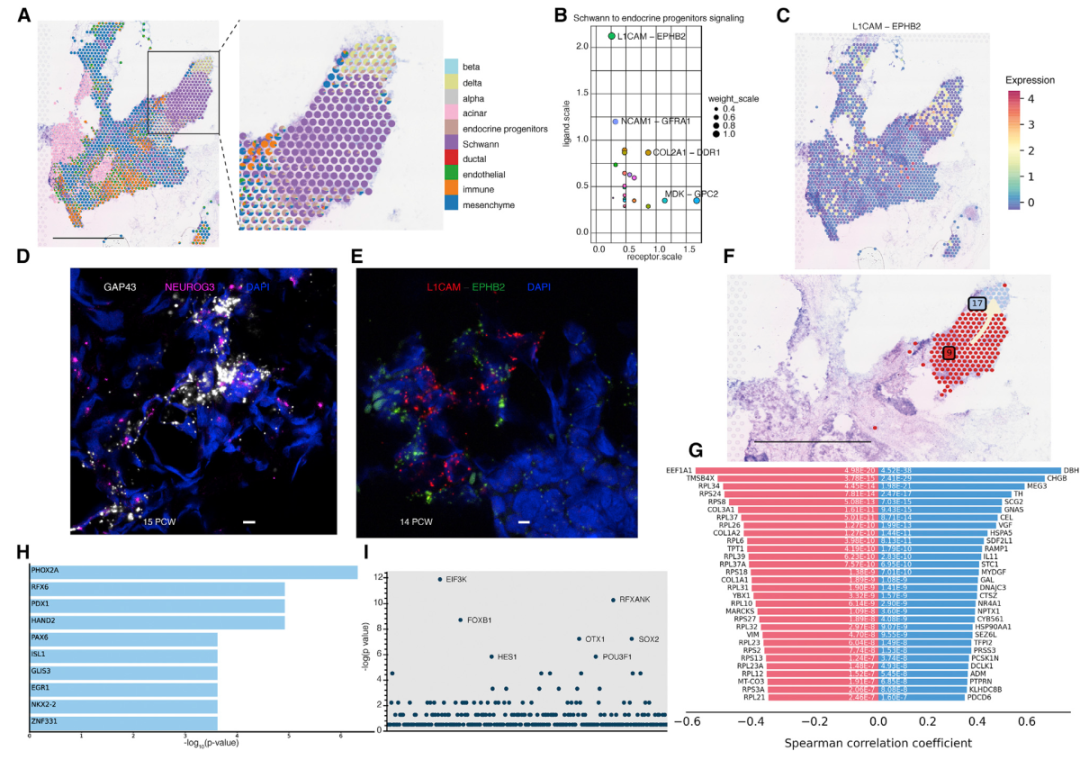
图2. Schwann细胞在内分泌细胞谱系特化中的作用。
尽管间充质在小鼠胰腺器官发生中发挥着重要的结构和生化作用【7, 8】,但人们对发育中的人类胰腺中的间充质细胞异质性知之甚少。因此,作者对scRNA-seq数据中的间充质细胞进行重新聚类,并根据差异表达基因确定了19个转录不同的亚群,提示其存在内部异质性。结合空间转录组学数据,作者发现在18和20 PCW时,间充质细胞主要位于胰腺的外围,并且通常与内皮细胞或免疫细胞相关,而腺泡细胞与其相邻,空间轨迹分析预测在18 PCW和20 PCW时从间充质细胞到腺泡细胞的转变。通过对参与这一转变过程关键基因的富集发现主要与Wnt/β-连环蛋白信号传导、平面细胞极性和腺上皮细胞发育通路相关。
关键时间窗内不同细胞间的协调相互作用对于器官发生至关重要,这项研究结合scRNA-seq和空间转录组学,鉴定了人类胎儿不同发育阶段胰腺中各类细胞的谱系动力学,提供了免费访问的网络资源 (https://www.humanpancreastelopment.org/)。在未来研究中,进一步探索β细胞谱系中分支依赖基因的内分泌谱系关系和功能作用对于优化体外生成功能性β细胞的方案非常重要。
原文链接:
https://doi.org/10.1016/j.cmet.2022.11.009
参考文献
1. hu, S., Russ, H.A., Wang, X., Zhang, M., Ma, T., Xu, T., Tang, S., Hebrok, M., and Ding, S. (2016). Human pancreatic beta-like cells converted from fibroblasts. Nat. Commun. 7, 10080. https://doi.org/10.1038/ ncomms10080.
2. Rezania, A., Bruin, J.E., Arora, P., Rubin, A., Batushansky, I., Asadi, A., O’Dwyer, S., Quiskamp, N., Mojibian, M., Albrecht, T., et al. (2014). Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotechnol. 32, 1121–1133. https://doi.org/10.1038/nbt.3033.
3. Nair, G.G., Liu, J.S., Russ, H.A., Tran, S., Saxton, M.S., Chen, R., Juang, C., Li, M.L., Nguyen, V.Q., Giacometti, S., et al. (2019). Recapitulating endocrine cell clustering in culture promotes maturation of human stemcell-derived b cells. Nat. Cell Biol. 21, 263–274. https://doi.org/10.1038/s41556-018-0271-4
4. Alvarez-Dominguez, J.R., Donaghey, J., Rasouli, N., Kenty, J.H.R., Helman, A., Charlton, J., Straubhaar, J.R., Meissner, A., and Melton, D.A. (2020). Circadian entrainment triggers maturation of human in vitro islets. Cell Stem Cell 26, 108–122.e10. https://doi.org/10.1016/j.stem.2019.11.011.
5. Mahaddalkar, P.U., Scheibner, K., Pfluger, S., Ansarullah, S., Sterr, M., Beckenbauer, J., Irmler, M., Beckers, J., Kno¨ bel, S., and Lickert, H. (2020). Generation of pancreatic b cells from CD177+ anterior definitive endoderm. Nat. Biotechnol. 38, 1061–1072. https://doi.org/10.1038/s41587-020-0492-5.
6. Yoshihara, E., O’Connor, C., Gasser, E., Wei, Z., Oh, T.G., Tseng, T.W., Wang, D., Cayabyab, F., Dai, Y., Yu, R.T., et al. (2020). Immune-evasive human islet-like organoids ameliorate diabetes. Nature 586, 606–611. https://doi.org/10.1038/s41586-020-2631-z.
7. Landsman, L., Nijagal, A., Whitchurch, T.J., Vanderlaan, R.L., Zimmer, W.E., Mackenzie, T.C., and Hebrok, M. (2011). Pancreatic mesenchyme regulates epithelial organogenesis throughout development. PLoS Biol., e1001143. https://doi.org/10.1371/journal.pbio.1001143.
8. Hibsher, D., Epshtein, A., Oren, N., and Landsman, L. (2016). Pancreatic mesenchyme regulates islet cellular composition in a patched/hedgehog-dependent manner. Sci. Rep. 6, 38008. https://doi.org/10.1038/ srep38008.


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |