*仅供医学专业人士阅读参考
病理视角--深入解读DB04研究中的HER2低表达检测。
一年一度的圣安东尼奥乳腺癌(SABCS)大会于12月10日圆满结束,本次大会纳入了一系列极具价值的临床研究进展。ADC作为近年来乳腺癌领域的明星抗肿瘤药物,不乏重磅成果惊艳亮眼,其中不得不提的当属新型ADC药物T-DXd的DESTINY-Breast(DB)系列研究数据,除了备受瞩目的DB02、DB03之外,将HER2低表达正式确立为抗HER2靶向治疗获益人群,并由此开启乳腺癌HER2三分法新时代的DB04研究同样再续辉煌,不仅公布了亚组分析数据,并且对HER2低表达检测相关内容(HER2-18)也进行了重点展示[1]。本文聚焦DB04研究入组患者的肿瘤样本特征分析,以及HER2低表达检测的一致性结果,特邀杨文涛教授从病理角度针对相关问题进行深入解读及探讨。
研究背景
在既往的研究及实践中,乳腺癌样本根据HER2的表达情况被分为HER2阳性(过度表达)和HER2阴性(非过度表达),并且在DB04研究之前,HER2低表达肿瘤在临床上尚缺乏特殊的治疗手段。而DB04研究证实了新型ADC药物T-DXd在HER2低表达乳腺癌人群中的显著治疗获益[2]:与接受研究者选择的化疗(TPC)患者相比,接受T-DXd治疗的HER2低表达转移性乳腺癌患者的无进展生存期(PFS)和总生存期(OS)显著延长。该研究成果突显了有效识别HER2低表达转移性乳腺癌患者的必要性,并且随着HER2低表达在乳腺癌领域的地位日益显著,HER2低表达准确检测的重要性也与日俱增。
然而,很多因素可能影响HER2低表达检测结果的准确性,其中比较重要的影响因素在于乳腺癌中HER2表达状态的异质性。HER2状态的异质性分为时空异质性和空间异质性。时间异质性可以体现为随着疾病进展,HER2状态可能发生变化。例如一项研究纳入547例患者,探索了原发性乳腺癌进展为局部复发或远处转移乳腺癌时HER2低表达的演变过程[3],结果发现新辅助治疗前后原发灶和转移灶HER2不一致的总发生率为38.0%,且主要由转换为HER2低表达或从HER2低表达发生转换的病例驱动。空间异质性则可以表现为不同来源部位样本,可能HER2状态会不同(穿刺vs 手术样本)。例如有研究显示[4],粗针活检(CBN)样本与手术切除(SEB)样本检测结果对比,对于HER2评分结果的整体一致率为1097/1829 (60.0%);按照HER2阳性、HER2低表达以及HER2 0三分法分析,结果一致率为1358/1829(74.2%)。这些共同表明,由于乳腺癌HER2异质性的存在,对来源于肿瘤原发灶或者转移灶,以及活检亦或是手术切除样本进行HER2检测时,其结果可能不同,但是到底应该基于什么样本判断HER2低表达状态目前仍缺乏足够证据。本次报道描述了DB04研究中转移性乳腺癌患者肿瘤样本的特征,并评估了肿瘤样本特征(肿瘤部位、标本类型、取样类型和取样日期)与疗效结果(PFS)之间的相关性,以及报道了既往确定的HER2评分和中心实验室HER2评分之间的一致性结果[2]。该研究进展或能为解答HER2低表达检测相关问题奠定一定的理论基础。
研究方法
DESTINY-Breast04研究是一项在既往接受过1-2线化疗的且被确定为HER2低表达(如下图)(免疫组化 [IHC]1+或IHC 2+且原位杂交 [ISH]阴性)转移性乳腺癌患者中进行的随机、开放性、III期研究。患者以2:1的比例随机接受T-DXd或研究者选择的化疗(TPC)。肿瘤样本在中心实验室使用PATHWAY HER2 4B5检测,HER2评分由训练有素的病理医生根据2018 ASCO/CAP HER2检测指南中的判断标准确定,如果样本为IHC 2+,则使用INFORM HER2 Dual ISH DNA Probe Cocktail检测HER2扩增状态。
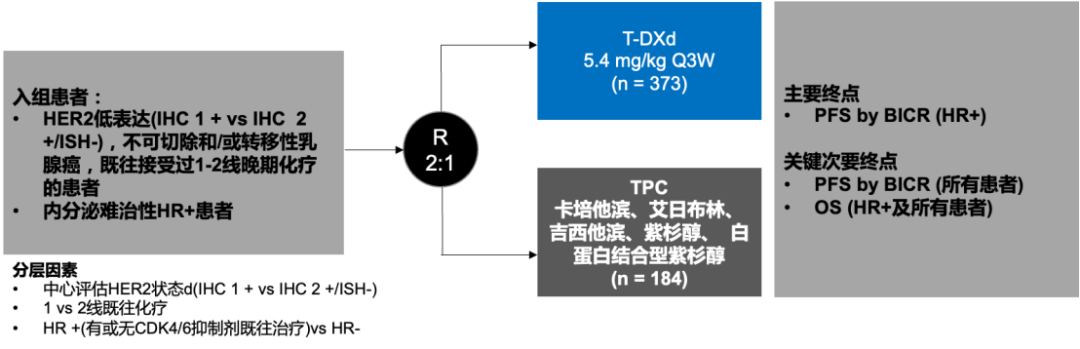
图1. 研究设计
研究结果
肿瘤样本类型分布
DB04 研究中肿瘤样本类型分布十分多样,入组患者中,64.5%的样本为转移灶样本,35.2%的样本来自原发灶;80.4%的样本为穿刺样本,19.4%的样本为手术切除样本;86.5%的样本为存档样本,13.5%的样本为新鲜获取样本;31.4%的样本为2014-2018期间获取,55.7%样本来自2019年及以后。
表1. 肿瘤样本类型分布

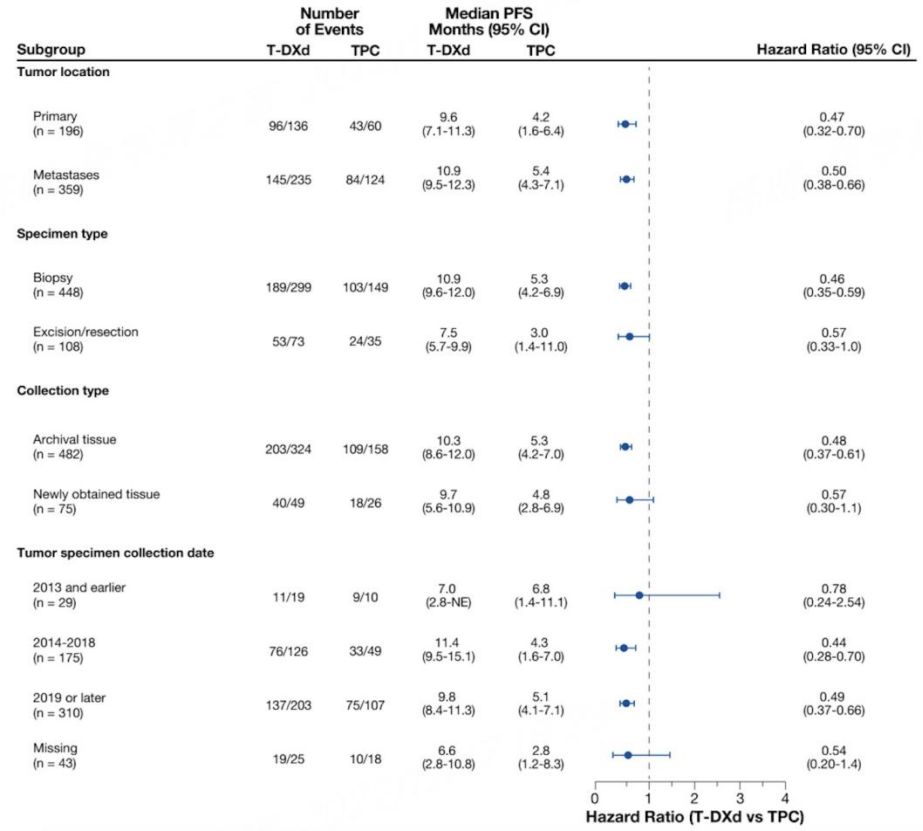
无论肿瘤样本特征如何,T-DXd相比TPC均有PFS显著获益
入组患者中,不管是来源于原发灶/转移灶、活检/手术切除、存档/新鲜采集组织、2014-2018/2019或之后采集的肿瘤样本,当其HER2评分为低表达,接受T-DXd治疗相比TPC组均有显著PFS获益,与总人群趋势一致。
表2. DB04入组患者按肿瘤样本特征分层的中位PFS
既往HER2检测结果与中心实验室检测结果一致性为78%
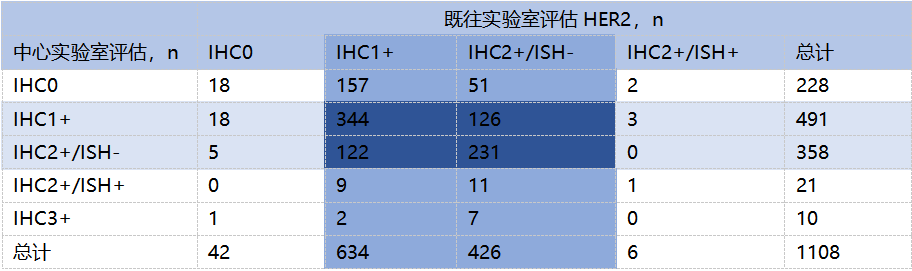
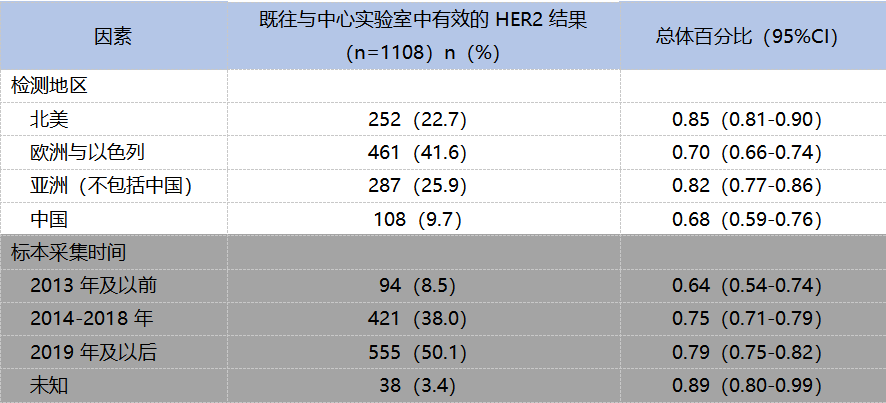
在提交肿瘤样本的1340例患者中,1108份样本同时具有既往(当地)和本次中心实验室 HER2 IHC检测结果;其中1060份样本根据既往(当地)检测结果被判读为HER2低表达(lHC 1+或IHC 2+/lSH-)。78%(823/1060) 根据既往(当地)检测结果被判读为HER2低表达的样本,经中心实验室检测后仍确认为HER2低表达。在22%(237/1060) 的不一致样本中,208/237(88%) 经中心实验室检测评分为IHC 0,29/237(12%) 经检测后评分为IHC2+/ISH+或IHC 3+。
表3. 中心实验室与既往HER2检测结果评估
既往检测与本次中心实验室检测肿瘤样本的HER2评分整体上趋于一致,但仍受到检测地区及标本日期的影响(如表3)。
表4. 与HER2评分相关的因素
研究结论
DB04研究入组患者肿瘤样本分布十分多样,并且在各种肿瘤样本特征的HER2低表达患者中观察到T-DXd相比TPC获益基本一致。
尽管既往缺乏区分HER2 IHC 0和HER2低表达(IHC 1+、IHC 2+/ISH–) 的临床应用和相关培训,并且HER2状态还受到不断演变的指南、当地检测方法的差异以及关键样本特征的差异(原发性 vs 转移性;存档 vs 新鲜;活检 vs 手术切除;样本采集日期)等多种因素的影响,78%既往检测判读为HER2低表达的肿瘤样本经中心实验室检测,仍被判读为HER2低表达乳腺癌。该比率与既往报告的HER2阳性(过表达)IHC检测结果的初始一致率相当(范围74-82%)[5,6]。
专家点评
对DB04研究结果中入组样本的思考
1. 原发灶和转移灶:HER2低表达乳腺癌存在时间和空间异质性,因此应尽可能对复发转移灶进行活检。但是临床实践中会遇到转移灶不可取或穿刺样本不足的情况。乳腺癌原发灶HER2低表达,转移灶为HER2 0的患者是否能从T-DXd治疗中获益,这是大家特别关注的问题。DB04研究结果显示,不管检测样本来源于原发灶还是转移灶,只要检测结果为HER2低表达,患者均可能从T-DXd的治疗中获益。比较遗憾的是,DB04研究中缺乏原发灶和转移灶的配对样本来直接回答这个问题,对于不同样本对临床决策以及治疗获益的影响,还有待于进一步探索。
2. 穿刺活检样本和手术切除样本:DB04研究结果显示无论是活检样本还是手术切除样本,只要免疫组化判读结果为HER2低表达乳腺癌,均观察到T-DXd 相比TPC具有显著治疗获益,与总人群保持一致的趋势。
3. 不同保存时间的样本:DB04研究结果显示2014-2018年间的样本与2019年以后的样本相比,T-DXd的获益类似。需要强调的是,肿瘤样本如果时间较为久远,可能会影响检测结果。DB04研究结果显示2013年之前的样本并不能很好的指导临床决策。应该注意到的是样本质量与实验室的保存方法相关,并非所有实验室2014-2018年之间的样本质量都是可靠的。在实践中需要额外关注样本质量,确保检测结果的可靠性与准确性。
对DB04中心实验室和地方实验室评分一致性的思考
DB04研究的中心实验室采用Ventana PATHWAY 4B5进行免疫组化检测,研究结果显示既往病理报告为HER2低表达者与中心实验室检测的HER2低表达一致性为78%。该一致率明显高于大家较为熟悉的另外一项来自耶鲁大学的研究。在耶鲁大学的研究中15家机构的18名病理学家对170例活检病例进行了HER2 免疫组化评价,18位病理医师阅片的IHC 0 和1+一致率仅26%[7]。该项研究中一致率如此低的主要原因有两点:第一是病理医生判读时并未被告知需严格区分HER2 1+和HER2 0,第二是该项研究采用了非常高的标准,即18位病理医生中17位一致才算最终结果一致。DB04的研究结果和既往另一项研究的结果类似,在这项研究中重新评分和历史HER2评分之间的总体一致性为81.2%,其中HER2低表达和HER2 0样本历史评分和重新评分之间的一致性分别为87.3%和70.1%[8]。
在DB04研究入组时,无论是临床医生还是病理医生并不太关注HER2 0和HER2 1+的区分,地方实验室和中心实验室存在一定的不一致性在预料之中。我们注意到不一致的病例中88%为地方实验室既往病理结果为HER2低表达,中心实验室为HER2 0,这提示可能有部分HER2 0被判为了HER2 1+,也就是存在不到10%的微弱细胞膜染色,但被高判为HER2 1+。不一致的另外一个原因是地方实验室和中心实验室的HER2检测平台和抗体可能不同。不同的研究显示采用非Ventana 4B5检测平台,HER2低表达的检出率存在差异[9,10]。DB04研究中地方实验室并非都采用Ventana 4B5平台,必然会存在与中心实验室检测结果的差异。令人遗憾的是,DB04研究中地方实验室的检测平台信息中69.3%并未获及,因此无法进行相关平台和抗体与患者进行T-DXd治疗疗效的比对。最近来自中国33个省市的850多名病理医生参与了乳腺癌HER2检测调研,结果显示采用Ventana 4B5进行HER2检测的约为40%。这可能是导致DB04入组病例中,中国实验室和中心实验室结果不一致的原因之一。究竟哪一种抗体和平台与T-DXd治疗疗效更相关,是评价抗体和平台的最有效依据。目前虽然有不同抗体和平台对HER2低表达检出率的比较研究,但缺乏与临床治疗疗效的相关性研究,希望这方面的空白能尽快被填补。
上述研究也共同表明,当前的免疫组化技术对于准确检测HER2低表达仍然存在局限性。鉴于HER2表达是一个持续变量,有必要探索出更可靠的方法实现HER2表达水平的准确判读。近年来人工智能辅助病理在HER2检测领域探索颇多,在本次SABC会议上也有相关报道[11,12]。其他HER2检测的方法也都在积极探索中,包括基于HER2蛋白质与mRNA水平的定量方法。这些新技术的探索一方面需要更多临床研究的验证,另一方面如何在病理科落地并成为每个乳腺癌患者都可及的检测技术也是很大的挑战。就目前来说,规范HER2检测全流程,进行HER2判读培训和检测质控活动,是提高乳腺癌HER2检测的有效手段。相信随着技术发展以及临床证据积累,加之临床医生和病理医生的共同努力,乳腺癌HER2检测必将越来越精准。
专家简介

杨文涛 教授
复旦大学附属肿瘤医院
医学博士,主任医师,博士生导师
复旦大学附属肿瘤医院病理科 副主任
中华医学会病理学会乳腺学组 组长
中国医促会病理学分会 副主任委员
中国抗癌协会乳腺癌专业委员会 常委
中国临床肿瘤学会肿瘤病理专家委员会 常委
中国抗癌协会肿瘤病理专业委员会 委员
上海市抗癌协会乳腺癌专业委员会 副主任委员
国际癌症报告合作组织(ICCR)乳腺癌病理报告模板制定专家组成员
第五版世界卫生组织(WHO)乳腺肿瘤分类编委
《诊断病理学杂志》副主编
《中华病理学杂志》、 《Virchows Archiv》杂志 、 《临床与实验病理学杂志》 编委
参考文献
[1]Prat A, Modi S, Tsurutani JJ, et al. Determination of HER2-low status in tumors of patients with unresectable and/or metastatic breast cancer in DESTINY-Breast04. 2022 SABCS. HER2-18.
[2]Modi S, Jacot W, Yamashita T, et al. DESTINY-Breast04 Trial Investigators. Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. N Engl J Med. 2022 Jul 7;387(1):9-20.
[3]Miglietta F, Griguolo G, Bottosso M, et al. Evolution of HER2-low expression from primary to recurrent breast cancer. NPJ Breast Cancer. 2021 Oct 12;7(1):137.
[4]Chen R, Qi Y, Huang Y, et al. Diagnostic value of core needle biopsy for determining HER2 status in breast cancer, especially in the HER2-low population. Breast Cancer Res Treat. 2022 Nov 8.
[5]Euhus DM, Smith KC, Robinson L, et al. Pretest prediction of BRCA1 or BRCA2 mutation by risk counselors and the computer model BRCAPRO. J Natl Cancer Inst. 2002 Jun 5;94(11):844-51.
[6]Jones SE, Savin MA, Holmes FA, et al. Phase III trial comparing doxorubicin plus cyclophosphamide with docetaxel plus cyclophosphamide as adjuvant therapy for operable breast cancer. J Clin Oncol. 2006 Dec 1;24(34):5381-7.
[7]Fernandez AI, Liu M, Bellizzi A, et al. Examination of Low ERBB2 Protein Expression in Breast Cancer Tissue. JAMA Oncol. 2022 Apr 1;8(4):1-4.
[8]Viale G, Basik M, Nikura N,et al.Retrospective Study to Estimate the Prevalence and Describe the Clinicopathological Characteristics, Treatment Patterns, and Outcomes of HER2-Low Breast Cancer.2022 SABCS.HER2-15.
[9]Layfield LJ, Frazier S, Esebua M, et al. Interobserver reproducibility for HER2/neu immunohistochemistry: A comparison of reproducibility for the HercepTest™ and the 4B5 antibody clone. Pathol Res Pract. 2016 Mar;212(3):190-5.
[10]Scott M, Vandenberghe M, Scorer P, et al. Prevalence of HER2 low in breast cancer subtypes using the VENTANA anti-HER2/neu (4B5)assay. 2021 ASCO.1021.
[11]Spitzmuller A, KapIl A, Shumilov A, et al. Computational pathology-based HER2 expression quantification in HER2-low breast cancer. 2022 SABCS. P6-04-03.
[12]Globerson Y, Bien L, Harel J,et al. A fully automatic artificial intelligence system for accurate and reproducible HER2 IHC scoring in breast cancer. 2022 SABCS. P6-04-05.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |