目前,炎症性肠病(Inflammatory Bowel Disease, IBD)由于发病率高且治愈率低,现已成为全球公共卫生问题。虽然该病的发病机制尚不清楚,但肠道微生物群与炎症信号之间存在的潜在关联已被建立,可以成为研究和防治该病的切入点。益生菌,尤其是乳酸杆菌和双歧杆菌,由于其安全有效性且强大的菌群调控能力,最近成为IBD的治疗热点。但是大多数研究对于多菌株组合与其代谢产物对IBD作用的评估还很少被报道。

2022年6月22日,谢黎炜研究员(华南应用微生物国家重点实验室、广东省科学院微生物研究所,肠道微生态与健康团队PI,广东省精准医学应用学会微生态医学分会副主任委员)及其所带领的实验室团队,在Microbiology Spectrum期刊上发表了题为“Probiotic Consortia and Their Metabolites Ameliorate the Symptoms of Inflammatory Bowel Diseases in a Colitis Mouse Model”的文章,该研究报道了实验室自主分离的本土益生菌菌株参与抑制肠道炎症和恢复肠道微环境的功效,其中,与对照组及单菌株处理组相比,罗伊氏乳杆菌,格氏乳杆菌,嗜酸乳杆菌和乳双歧杆菌的微生态制剂或其发酵代谢产物联用在抑制结肠炎模型的肠道炎症和加速炎症以及肠道微环境恢复方面具有独特的效果。该研究的发现支持该混合益生菌专利菌株及其代谢物联用,辅助治疗IBD 的新方法和新策略。
IBD是发生在胃肠道内的慢性非特异性炎症性疾病,主要包括溃疡性结肠炎和克罗恩病两种疾病类型[1],大部分患者的临床表现为腹痛,腹泻,血便,肛周病变,伴有体重降低,营养不良等[2,3]。IBD易反复发作,难以治愈且有很大风险会发展为结直肠癌(Colorectal cancer, CRC),虽然通常被认为是西方国家常见的肠道炎症性疾病,但近年来,在发展中国家,该病的发病率正在加速上升,严重增加患者的疾病负担及损害生活质量[4–6]。IBD的确切发病原因至今仍不明确,但已有较多证据认为,该病是基因,环境多方面复杂因素共同作用的结果,同时,持续的肠道感染、肠黏膜免疫调节异常和肠道微生物群失调对IBD的发生发展也密切相关。其中,肠道微生物群被报道出是疾病进展的关键因素之一,结肠炎个体的肠道菌群组成(类型和数量)与健康个体不同,会激活宿主免疫反应,这会增加肠道的通透性并破坏肠黏膜的屏障结构,进而破坏共生微生物并激活严重的免疫反应,导致疾病反复发作[7–9]。
众所周知,益生菌是定植于人体肠道以对肠道产生有益影响的活微生物,作为益生菌的两个主要属,双歧杆菌和乳酸杆菌由于能介导短链脂肪酸的形成也被报道出对IBD和CRC症状的改善具有潜在益处[10]。除此之外,乳酸杆菌和双歧杆菌还能通过增加健康益生菌对肠粘膜的粘附、抑制病原体粘附在粘膜表面、竞争性排除病原微生物、产生抗菌物质和调节免疫功能来重建肠道共生及保护肠道粘膜[11]。而本次研究所用的益生菌专利菌株包括罗伊氏乳杆菌,格氏乳杆菌,嗜酸乳杆菌和乳双歧杆菌,它们分别属于乳杆菌属和双歧杆菌属,该菌混合制剂配方符合国家食品添加标准。尽管已有研究证明这四种菌在宿主体内具有积极作用。然而,该菌及其代谢产物在葡聚糖硫酸钠(Dextran Sulfate Sodium, DSS)诱导结肠炎中的综合作用尚未清晰地评估比较,潜在的机制也仍须进一步阐明。
本研究采用14周龄小鼠建立DSS诱导的结肠炎模型,实验周期为14天。根据实验条件将小鼠分为7组:CONTROL, control group; MIX, probiotic consortia; LR1, Lactobacillus reuteri PLBK®1 group; LR2, Lactobacillus reuteri PLBK®2 group; LG, Lactobacillus gasseri PLBK®3 group; LA, Lactobacillus acidophilus PLBK®4 group; BL, Bifidobacterium lactis PLBK®5 group。其中,6组实验组的小鼠需要每天灌胃相对应的单菌株或者益生菌混合制剂,在整个益生菌干预实验过程中,每天记录体重、粪便硬度变化、血便情况等实验指标,另外,在第8天和第14天需要收集粪便进行16S rRNA测序,小鼠处死后还需要收集结肠组织以便进行后续苏木精和伊红(Hematoxylin and eosin, H&E)染色和免疫组织化学(Immunohistochemistry, IHC)实验(图1A)。通过分析发现益生菌制剂减轻了小鼠结肠炎的病理症状。与对照组相比,MIX组能改善DSS引起的结肠缩短(图1B),减轻了体重的变化波动(图1C)并显著降低了疾病活动指数(Disease Activity Index, DAI)的评分(图1D),另外,可以观察出单菌株组对于体重变化和DAI评分的降低效果不如MIX组显著(图1)。
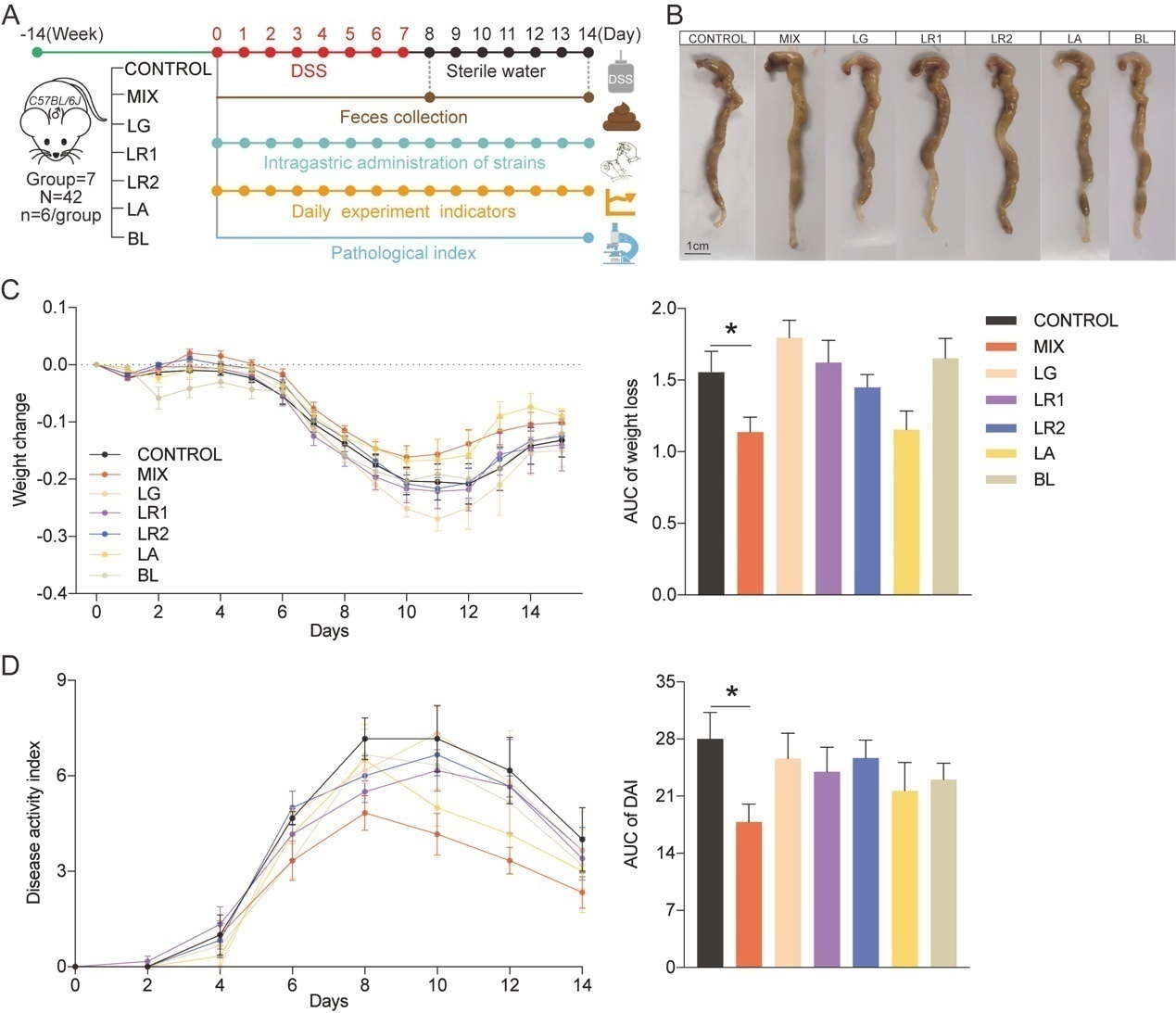
图1 益生菌制剂可缓解 DSS 诱导实验性结肠炎的病理症状
对结肠切片进行H&E染色以评估结肠粘膜损伤情况,从对照组的结肠切片可发现肠道结构和屏障发生了破损。相比之下,益生菌制剂的处理对结肠具有保护作用,且组织学评分也显著较低。另外,尽管在单菌株组中仍可以观察到炎症,但是大部分的隐窝结构是正常的,尤其在LA组,表现为较低的结肠病理学评分(图2A)。进一步利用免疫组化,以检测与炎症有关的巨噬细胞标志物-F4/80,处理结果与H&E染色结果一致,与对照组相比,MIX组的F4/80水平明显降低(图2B),表明先天免疫细胞向结肠的浸润减少。
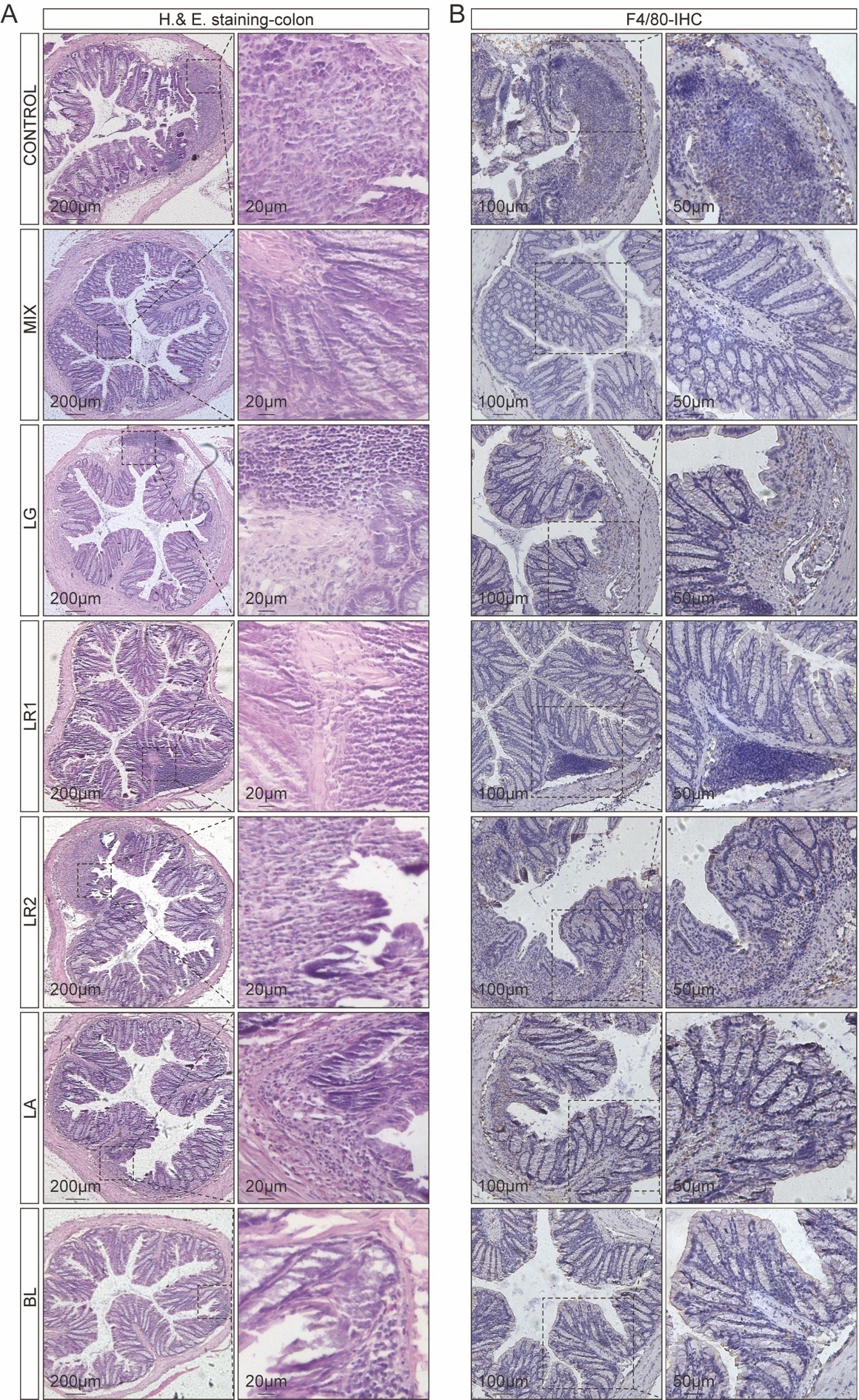
图2 益生菌制剂保护DSS诱导结肠炎模型的肠道结构并抑制巨噬细胞的浸润
将粪便样本进行16S rRNA测序以探究益生菌菌株对结肠炎肠道菌群的调节作用。结果发现,在不同的实验时期,7组肠道微生物群的组成在物种水平上存在差异(图3A-B), 且与对照组相比,MIX组在第8天的Simpson指数显著不同,而其他单菌株组则无显著差异(图3C),表明益生菌制剂干预能对群落组成和多样性产生影响,从而进一步加速了炎症的恢复。此外,无论在第八天还是14天,β多样性都显示出,对照组和MIX组的肠道微生物群被明确地分为两个集群,而第八天单菌株组的差异则不显著(图3E-H),这些结果表明,与单菌株相比,益生菌制剂处理对肠道炎症持续期和恢复期的肠道菌群都具有调节作用。且对照组和MIX组在两个阶段也显示出明显不同的细菌成分组成(图3I-J)。

图3 益生菌制剂重构肠道微生物群的组成
除此之外,为了在肠道炎症期间进一步识别起作用的微生物标志物,该研究主要对MIX组和对照组分别在第8天和第14天采取随机森林结合5倍交叉验证算法(Random forest analysis and 10 trials of 5-fold cross-validation, RFCV)来进一步识别特征细菌(图4A, C)。分析后发现有显著差异的菌为11株,在8天有7株菌(图4B),在第14天有4株菌(图4D),其中,有8株菌株在单菌株组中并无统计学差异(补充图),这些数据表明,益生菌制剂极有可能通过对肠道微环境的特异性调节而发挥综合作用。 为探究对照组和MIX组中菌群与表型之间的相互作用,还分析了共发生网络图,结果发现通过RFCV筛选出来的4株关键菌在三个网络图中均可发现,且第8天显示较为复杂的互作网络关系(图4E-G),提示这4株关键菌在益生菌制剂调控肠道微生态和疾病表型中的重要性。
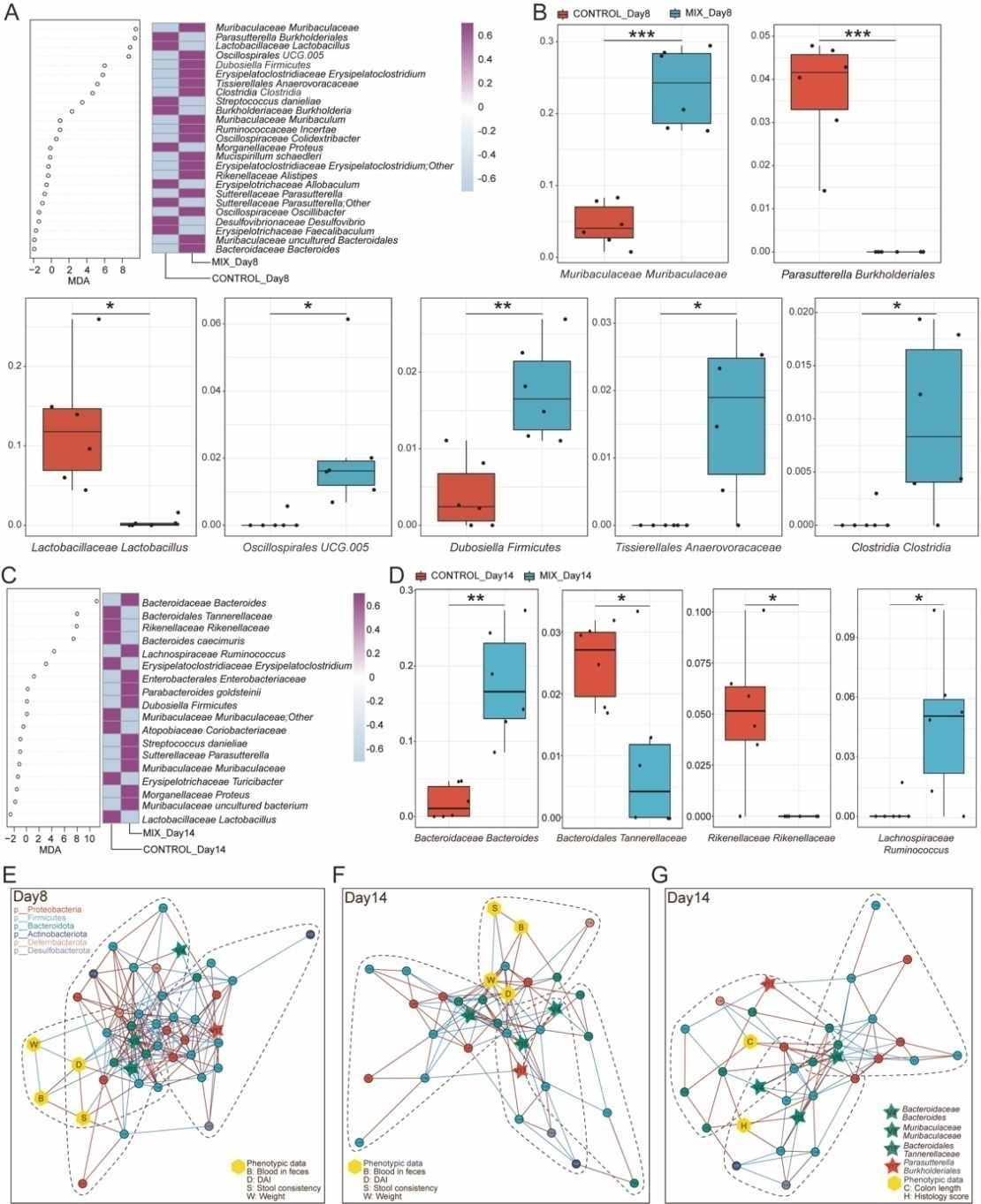
图4 通过随机森林鉴别结肠炎小鼠模型中的标志性肠道微生物群
考虑到益生菌制剂除平衡肠道菌群之外,还能产生大量的代谢物并被肠上皮细胞吸收,为了进一步探究该益生菌制剂的代谢产物对结肠炎的影响,该研究将未纯化的益生菌发酵代谢产物应用于结肠炎模型。由于益生菌制剂的效果优于单菌株,因此代谢产物干预仅对照和混合代谢物两组:对照组和混合代谢产物的MIX组。并在第14天收集小肠(Small intestine, SI)内容物(图5A)。分析发现,对照组由于DSS处理,导致了结肠缩短(图5B),体重变化较大(图5C),而混合代谢产物则明显降低了DAI评分(图5D),提高了生存率(图5E)。同时,在对照组中,H&E染色和IHC的结果显示出DSS处理引发了隐窝损失、粘膜破坏以及F480的表达增多(图5F-G),而这些情况在经过混合代谢产物的干预后都得到了明显的缓解。另外,通过对比益生菌干预实验的表性结果,可以发现益生菌制剂比混合代谢物更能有效地减轻体重损失和粘膜损伤。
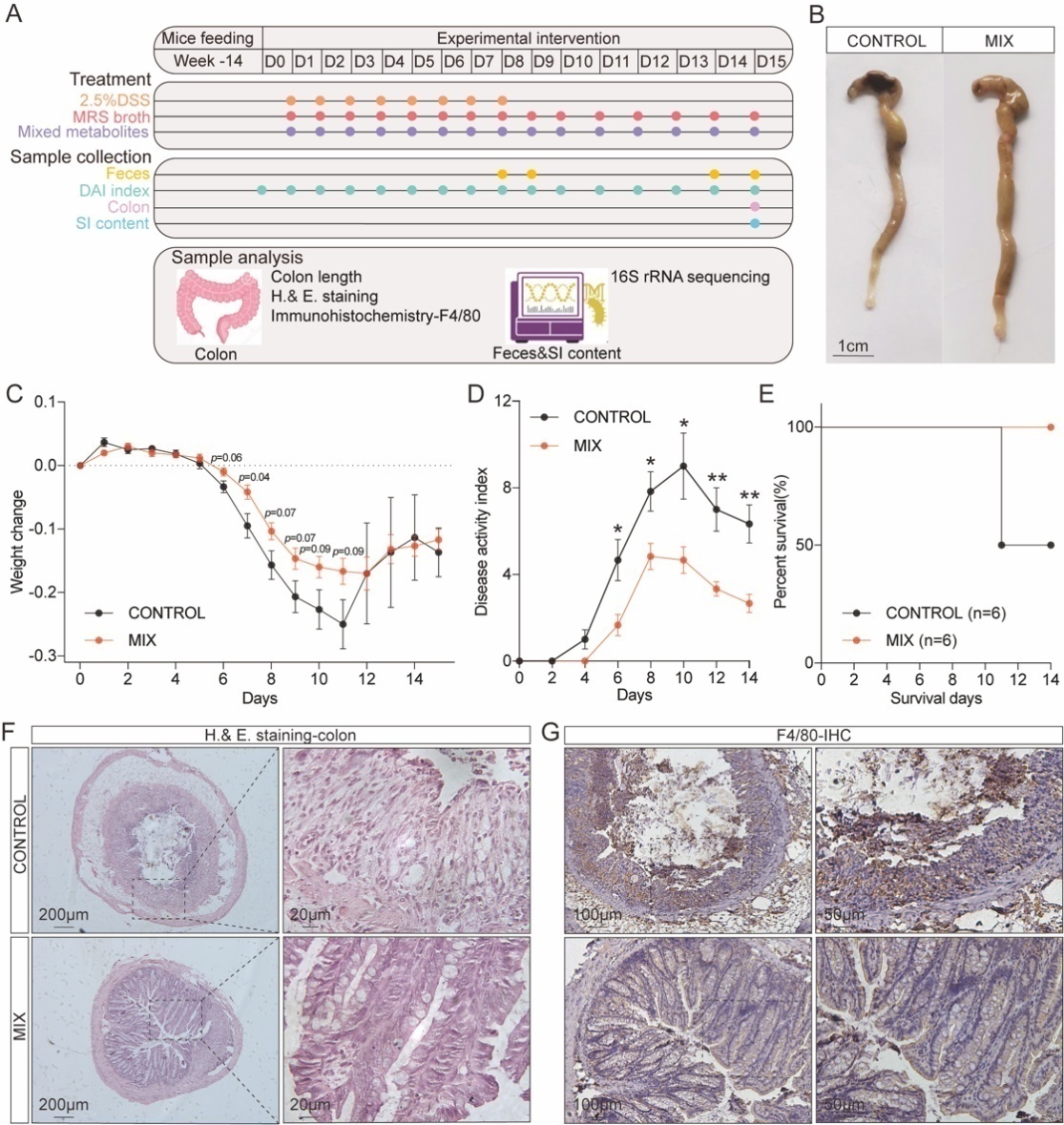
图5 混合代谢物减轻结肠炎小鼠模型的结肠损伤
为探究代谢物处理对微生物群的调节作用,该研究还对混合代谢产物干预中收集的粪便进行16S rRNA测序。结果发现,在第14天,两组结肠粪便样本的多样性及在益生菌干预中筛选出的关键菌同样都没有统计学差异(图6A-D),另外,共发生网络图也显示出关键菌在网络结构中大多表现为孤立的点(图6E-G)。提示混合代谢产物对结肠菌群调节的能力较小,同时结合文献研究发现,近端小肠是微生物代谢物吸收的主要场所[12,13],因此假设混合代谢物可能更有效地影响小肠中的细菌。为了验证此猜想,本研究对小肠内容物进行了16S rRNA测序,发现MIX组和对照组的β多样性存在显著性差异(图6H)。对核心菌群的热图分析发现两组中的菌群存在明显不同(图6I)。这些结果支持该假设,即混合代谢物显著改变了小肠的细菌组成和结构。

图6 在DSS诱导的结肠炎小鼠模型中,混合代谢物干预在特异性调节肠道微生物方面次于益生菌制剂
总体而言,目前的研究证明,罗伊氏乳杆菌PLBK®1,罗伊氏乳杆菌PLBK®2,格氏乳杆菌PLBK®3,嗜酸乳杆菌PLBK®4和乳双歧杆菌PLBK®5的混合益生菌制剂干预可减轻结肠炎肠道炎症,通过对肠道细菌水平的调控使结肠炎小鼠失调的微生物群组成和功能得以改善,且证明了肠道菌群和结肠炎表型之间具有复杂的相关性。为益生菌在维持肠道健康方面提供新见解,并将促进IBD和其他炎症性疾病的预防和治疗策略的发展。五株专利菌株的微生态制剂产品(白云山和黄药业联合出品的三高伴侣®微生态制剂),目前在新乡医学院附属第一医院消化科正在开展IBD和UC患者的微生态直接临床干预研究(伦理编号:[2001]伦科快审字 (23)号)。
本研究的主要完成人,第一作者许莉敏是新乡医学院公共卫生学院的硕士研究生;共同第一作者刘秉东是暨南大学第一附属医院精神医学科潘集阳教授与华南应用微生物国家重点实验室谢黎炜研究员联合培养博士研究生;黄柳菁是南方医科大学珠江医院妇产科马颖教授与华南应用微生物国家重点实验室谢黎炜研究员联合培养硕士研究生;李泽是新乡医学院公共卫生学院的在读硕士研究生;本文的通讯作者为新乡医学院公共卫生学院特聘教授、硕士生导师,南方医科大学珠江医院内分泌代谢科特聘教授、博士生导师,广东省科学院微生物研究所、华南应用微生物国家重点实验室、肠道微生态与健康团队PI谢黎炜研究员。
| 留言与评论(共有 0 条评论) “” |