*仅供医学专业人士阅读参考
口服SERD最新研究进展有哪些?背后的临床启示有哪些?速来打卡。
对于HR+/HER2-乳腺癌而言,内分泌治疗不可或缺。常见药物包括选择性雌激素受体调节剂(SERM,如他莫昔芬)、选择性雌激素受体下调剂(SERD,如氟维司群)、芳香化酶抑制剂(AI)等。从作用机制上看,AI通过抑制雌激素生成发挥抗肿瘤效应,而他莫昔芬和氟维司群均能阻断雌激素受体(ER),但是氟维司群作为目前唯一一个既能结合、阻断又能降解ER的内分泌药物,具备抑制和灭活受体的双重作用,机制上更优于SERM。不仅如此,由于ESR1突变可导致ER不依赖于雌激素而异常活化,是AI耐药的重要原因,而携带ESR1突变者对氟维司群治疗仍相对敏感[1,2]。
氟维司群优势明显,是乳腺癌内分泌治疗的重要选择,但是由于注射剂型可能限制这类疗法的使用范围,这促使行业开始寻找一种更加便捷、可及性更高的新药物剂型。口服SERD应运而生,并成为多家药企竞相角逐的重要领域。2022年欧洲肿瘤内科学会(ESMO)大会就有3个口服SERD的4项研究亮相,“医学界肿瘤频道”特邀中山大学肿瘤防治中心夏雯教授针对口服SERD的最新研究进展进行解读。
口服SERD最新研究进展
目前,已有多款口服SERD公布了I-II期研究数据而备受关注,本文聚焦ESMO大会报道,对美纳里尼的口服SERD Elacestrant、罗氏的Giredestrant、赛洛菲的Amcenestrant的最新研究进展进行盘点和分析,以飨读者。
Amcenestrant的研究进展
基于Amcenestrant开展的AMEERA系列研究探索可谓充满波折,在Amcenestrant的I/II期AMEERA-1研究中, Amcenestrant联合哌柏西利针对ER+/HER2-绝经后女性乳腺癌患者确认的ORR为5/46(10.9%)。总体临床获益率(CBR)为13/46(28.3%)[3]。尽管从疗效数据上看,Amcenestrant联合哌柏西利治疗ER+/HER2-绝经后乳腺癌显示出了初步的临床获益,但在今年的3月,赛诺菲便宣布其AMEERA-3研究未能达到主要终点PFS[4],本次ESMO大会则公布了详细数据。
II 期AMEERA-3研究旨在评估 Amcenestrant 单药治疗相较于医生选择的单药内分泌治疗(TPC,包括氟维司群、芳香化酶抑制剂,或他莫昔芬)在既往接受过内分泌治疗的 ER+/HER2-局部晚期或转移性乳腺癌患者中疗效和安全性。2022年ESMO公布的结果显示[5],AMEERA-3研究未能达到主要终点,两组每个独立中心审查(ICR)评估的PFS数值相似(3.6个月 vs 3.7 个月,HR=1.051,95% CI: 0.789-1.4; P=0.6437)。由研究者评估的结果以及各预先设定的亚组(包括ESR1突变)中均与前述结果一致。OS同样在数值上相近(数据尚未成熟)。结果显示,Amcenestrant并不能为内分泌治疗耐药的ER+/HER2-晚期乳腺癌带来生存获益。
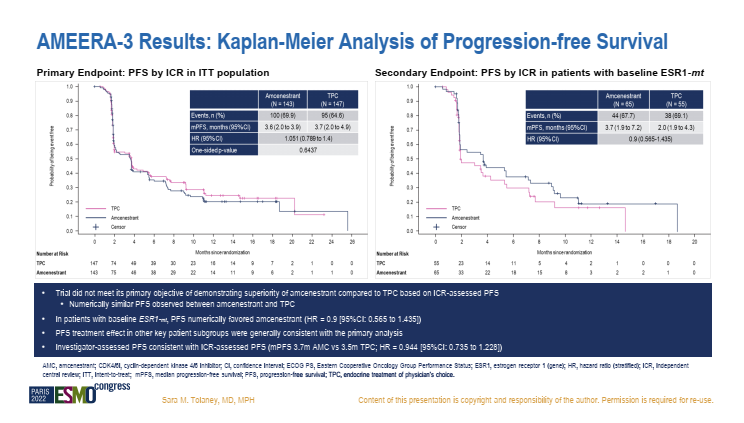
图1. AMEERA-3研究的PFS结果
不仅如此,Amcenestrant的III期AMEERA-5研究同样以失败告终,并且基于该研究结果,今年的8月,赛洛菲正式发布宣告声称,将停止Amcenestrant的所有全球开发计划[3]。Amcenestrant的失败,无疑为口服SERD的研发敲响了警钟。
Giredestrant的相关研究进展
Giredestrant既往已发表的研究结果显示,在晚期乳腺癌中,其单药或联合治疗均具有良好的抗肿瘤活性和耐受性。例如Giredestrant的Ⅰb期研究显示[6],针对既往接受过≤2种治疗的局部晚期或转移性ER+/HER2-乳腺癌患者,Giredestrant显示出良好疗效,且ESR1突变患者同样有效。但是Giredestrant的II 期acelERA BC研究成果却遭遇了挫折,早在今天4月,罗氏就公布该研究未能达到改善PFS的主要研究终点[7],其详细数据则在本次ESMO大会予以公布。
II期acelERA BC研究纳入既往接受过≥2 线治疗(必须包含内分泌治疗)的晚期 ER+/HER2-乳腺癌,探索 Giredestrant相比医生选择的内分泌疗法(PCET,氟维司群或芳香化酶抑制剂)作为二线或三线疗法的疗效和安全性。此次公布的数据显示[8], Giredestrant和PCET组的CBR分别为31.8% 和21.1%;ORR分别为12.6%和7.2%。研究者评估的PFS分别为5.6个月和5.4个月, HR=0.81(95% CI: 0.60, 1.10, p=0.18)。OS 数据暂未成熟。研究结果表明,acelERA BC未达到 INV-PFS 主要终点,Giredestrant仅表现出相较于PCET数值上的改善。这对于新兴的口服SERD的探索似乎又是一次打击。但CBR和ORR数值上更高,且值得注意的是,在 ESR1突变患者中PFS获益更加显著。提示Giredestrant在ESR1突变患者中似乎有前景,但还需更大样本量研究来验证。

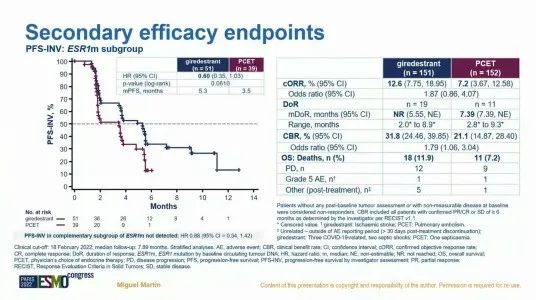
图2. acelERA BC研究的主要研究终点和次要研究终点(PFS结果)
虽然Giredestrant在晚期乳腺癌中的研究探索不尽人意,但其在早期乳腺癌新辅助治疗领域中的表现却令人欣慰,Ⅱ期coopERA研究对比了Giredestrant与阿那曲唑分别联合哌柏西利用于ER+/HER2-早期乳腺癌新辅助治疗的疗效和安全性。最终分析结果表明[9],Giredestrant联合哌柏西利组相比阿那曲唑联合哌柏西利组在手术时观察到对Ki67的抑制作用更强,并且在手术时实现了更大程度的完全细胞周期阻滞(CCCA;Ki67 ≤2.7%)。但两组的ORR相似(50% vs 49%)。此次公布了该研究的生物标记物亚组分析结果[10],在具有高危特征如较高的ACC分期、淋巴结阳性和孕激素受体(PgR)阴性的肿瘤中,观察到Giredestrant联合组治疗2周的Ki67下降水平更为显著。并且观察到ER、PgR蛋白也有大幅下降。
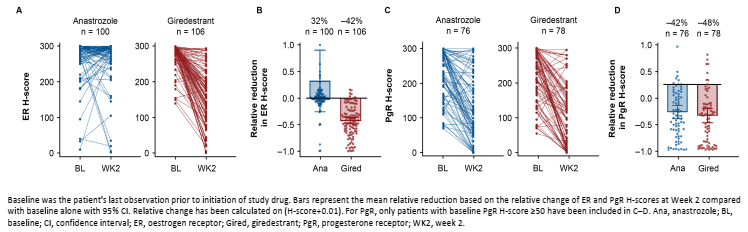
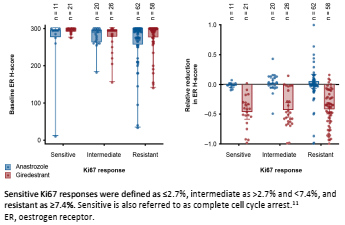
图3. coopERA研究的生物标志物分析结果
不仅如此,Giredestrant在早期乳腺癌辅助治疗领域也进行了积极探索。LidERA是在ER +/HER2-早期乳腺癌患者中比较Giredestrant与内分泌单药辅助治疗的III期研究[11],目前正在进行中。
Elacestrant的相关研究进展
前述两个口服SERD类药物虽经历失败,但并不意味着口服SERD会一直走向低迷,Elacestrant的出现为口服SERD类药物的研发之路带来希望。在其III期EMERALD研究中,纳入既往接受过1或2次内分泌治疗的患者,所有患者均接受过CDK4/6抑制剂治疗。随机分配至Elacestrant和标准内分泌治疗组(SOC,包括氟维司群,阿那曲唑,来曲唑或依西美坦)。研究的主要终点是总体人群和ESR1突变患者的PFS。2021年SABCS公布的结果显示[12],该研究达到了两个主要终点。总人群中,Elacestrant组和SOC组的中位PFS分别为2.79个月和1.91个月(HR=0.697 [95% CI: 0.552~0.88];P=0.0018)。在ESR1突变人群中,两组的中位PFS 分别为3.78个月和1.87个月(HR=0.546 [95% CI:0.387~0.768];P=0.0005)。2022年ESMO大会公布了该研究中Elacestrant对比不同内分泌治疗药物的亚组分析结果[13],不管在总人群还是ESR1突变亚组人群中,Elacestrant相比氟维司群、AI都有显著的PFS获益。进一步验证了Elacestrant单药在ER+/HER2-晚期/转移性乳腺癌二线或三线治疗中的潜力。

基于该研究成果,FDA已于今年8月授予了Elacestrant优先审查资格[14],这意味着Elacestrant有望成为首个获批上市的口服SERD药物。同时Elacestrant的成功更是重新树立了研究者继续探索口服SERD的信心。
专家点评
氟维司群是一种采用肌肉注射的SERD类药物,既往一系列研究充分证实了其在HR+晚期乳腺癌的重要价值,目前,氟维司群已经成为HR+/HER2-晚期乳腺癌内分泌治疗的基石之一。
早在氟维司群问世之初,就曾尝试开发SERD口服剂型。新型口服SERD类药物通过化学结构修饰以改善ER降解化合物的溶解度和极性,并经过多次更新迭代,进一步提高生物利用度[15]。并且在用药方式上更加便捷,能有效增加患者的治疗依从性。然而在提高生物利用度、用药便捷性的同时,其疗效是否优于氟维司群,是正在探索的问题。另外,ESR1突变是内分泌治疗的难点,相比氟维司群,口服SERD是否显示出更多优势,也是未来临床上关注的热点方向。通过今年ESMO的研究数据,我们也得出了一些临床启示。
首先,口服SERD和氟维司群疗效PK,孰优孰劣?
对于HR+/HER2-晚期乳腺癌患者而言,目前氟维司群单药或者氟维司群联合CDK4/6抑制剂都是常用的晚期标准治疗选择。对于上述3个口服SERD类药物,从研究入组人群的角度来看,EMERALD研究(100%)和AMEERA-3研究(80%)均纳入了较高比例的CDK4/6抑制剂经治患者,而acelERA BC研究仅入组了40%的CDK4/6抑制剂经治患者。且相比较而言,EMERALD研究的入组人群更后线,这可能是PFS更短的原因之一。此外,值得关注的是,上述临床研究对照组中医生选择的内分泌治疗药物为氟维司群的患者比例均较高,3个研究分别为69%、90%、75%,可以说是主要对比氟维司群。但目前仅EMERALD研究在总人群取得了统计学差异,且本次ESMO分析了对比氟维司群的疗效,和全人群一致。而另外两个口服SERD则未见疗效的显著差异,因此目前除剂型优势外,疗效上还未见到额外的获益,当然也还需要更多数据来证实。

图5. 3个口服SERD类药物临床研究对比
其次,口服SERD能否克服ESR1突变引起的内分泌治疗耐药?
临床及临床前研究[16-18]均表明,ESR1突变主要在接受内分泌治疗,尤其是AI治疗后的复发转移乳腺癌中富集,在内分泌耐药患者中比例可达30-40%[19]。并且有研究者发现所有携带ESR1突变的患者既往均接受过AI治疗[20]。而对SoFEA及PALOMA-3试验的回顾性分析[22]显示,在AI治疗后,采用ctDNA检测ESR1突变,可携带ESR1突变者对氟维司群治疗仍相对敏感,后续的SoFEA及EFECT联合分析也证实了氟维司群在ESR1突变患者中的预后优势[23]。因此,对于AI耐药的ESR1突变患者,可尝试选择含氟维司群的治疗方案。更好地克服ESR1突变导致的耐药是口服SERD的开发动机之一,但具体疗效如何呢?
从研究本身数据来看,对于ESR1突变亚组人群而言,目前仅有Elacestrant相比医生选择的内分泌治疗药物具有显著获益,两组中位PFS分别为3.8个月和1.9个月(HR=0.65,P=0.0049)。另外两个口服SERD PFS仅具有数值上的优势,其中Amcenestrant HR=0.9,研究也已中止;而Giredestrant的PFS HR=0.6,P=0.06,考虑到样本量的问题,虽然未获得统计学差异,但显示出潜力,还需进一步数据验证。提示对于ESR1突变患者而言,不同药物的疗效差异可能也较大,期待更多数据来探讨。
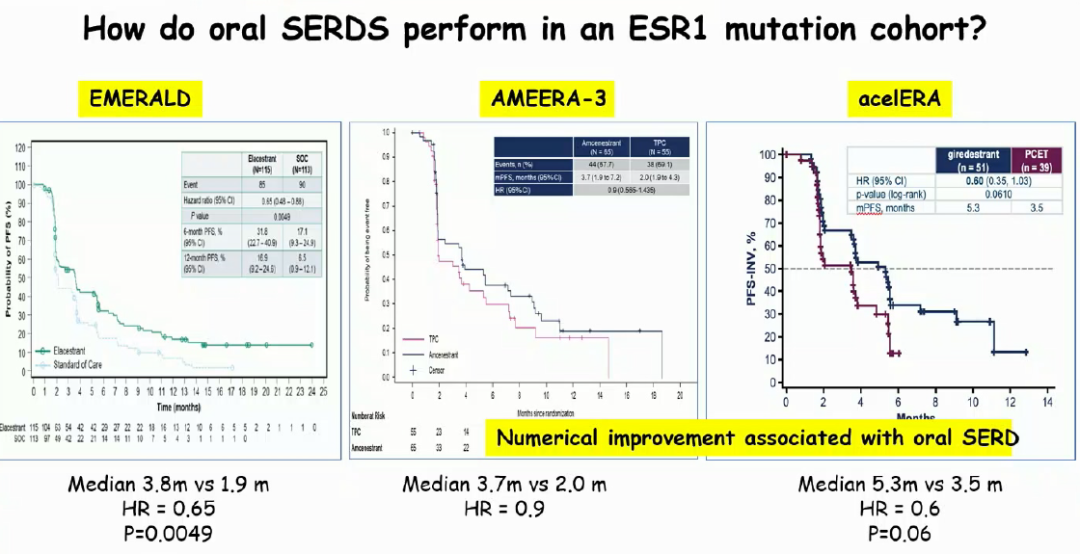
图6. 3个口服SERD类药物在ESR1突变亚组人群中的治疗获益
总结与展望
从上述研究进展来看,尽管口服SERD的研发并非一帆风顺,但是其探索之路还远远没有结束,例如Giredestrant、Elacestrant仍在继续进行后续临床布局,还有众多国内外药企均在口服SERD研发领域取得了初步成果或正在布局。这些都表明,口服SERD的应用前景仍然值得期待,希望更多研究数据能早日披露,进一步丰富HR+/HER2-乳腺癌的内分泌治疗策略。
专家简介

夏雯
中山大学肿瘤防治中心 内科 副主任医师 硕士生导师
北京协和医学院(清华大学医学部)博士
第六届“羊城青年好医生”
中国研究型医院学会乳腺癌专业委员会常委
广东省胸部疾病学会乳腺病防治专业委员会常委
广东省抗癌协会乳腺癌专业委员会青委会委员
广东省抗癌协会遗传肿瘤专业委员会委员
广东省胸部肿瘤防治研究会乳腺癌专业委员会委员
JCO中文版青年编委美国Case Western Reserve University附属University Hospital,Cleveland及法国Pitie-Salpetrere,Paris交流学习。
CN-103093 Expiration Date: 2023-9-22
声明:本材料由阿斯利康支持,仅供医疗卫生专业人士参考
参考文献
[1].王佳玉综述, 徐兵河审校. 氟维司群治疗绝经后激素受体阳性晚期乳腺癌的研究进展[J]. 中国癌症杂志, 2016, 26(5):5.
[2].李芷君, 徐兵河. 乳腺癌芳香化酶抑制剂耐药的研究进展[J]. 中国癌症杂志, 2021, 31(2):9.
[3].Bardia, A.,Chandarlapaty, S., Linden, H.M. et al. AMEERA-1 phase 1/2 study of amcenestrant, SAR439859, in postmenopausal women with ER-positive/HER2-negative advanced breast cancer. Nat Commun 13, 4116 (2022).
[4].https://www.sanofi.com/en/media-room/press-releases/2022
[5].Tolaney SM, Chan A, Petrakova K , et al. AMEERA-3, a phase II study of amcenestrant (AMC) versus endocrine treatment of physician’s choice (TPC) in patients (pts) with endocrine-resistant ER+/HER2− advanced breast cancer (aBC). 2022 ESMO. 212MO.
[6].Komal L. Jhaveri, Valentina Boni, Joohyuk Sohn, et al. Safety and activity of single-agent giredestrant (GDC-9545) from a phase Ia/b study in patients (pts) with estrogen receptor-positive (ER+), HER2-negative locally advanced/metastatic breast cancer (LA/mBC). 10.1200/JCO.2021.39.15_suppl.1017 Journal of Clinical Oncology 39, no. 15_suppl (May 20, 2021) 1017-1017.
[7].Roche's oral SERD giredestrant fails breast cancer trial -
[8].Jimenez MM, Lim E, Gregor MC,et al.Giredestrant (GDC-9545) vs physician choice of endocrine monotherapy (PCET) in patients (pts) with ER+, HER2– locally advanced/metastatic breast cancer (LA/mBC): Primary analysis of the phase 2, randomised, open-label acelERA BC study.2022 ESMO.211MO.
[9].Peter A. Fasching, Aditya Bardia, Vanesa Quiroga, et al. Neoadjuvant giredestrant (GDC-9545) plus palbociclib (P) versus anastrozole (A) plus P in postmenopausal women with estrogen receptor–positive, HER2-negative, untreated early breast cancer (ER+/HER2– eBC): Final analysis of the randomized, open-label, international phase 2 coopERA BC study.2022ASCO. 589.
[10].Bardia A, Fernando TM, Fasching PA,et al. Neoadjuvant giredestrant (GDC-9545) + palbociclib (P) vs anastrozole (A) + P in postmenopausal women with oestrogen receptor-positive, HER2-negative, untreated early breast cancer (ER+/HER2– eBC): Biomarker subgroup analysis of the randomised, phase II coopERA BC study.2022 ESMO. 144P.
[11].ClinicalTrials.gov Identifier:NCT04961996 2021 SABCS. OT2-11-09.
[12].Positive EMERALD Trial Results for Elacestrant Presented at San Antonio Breast Cancer Symposium 2021
[13].Aftimos PG,Cortés J,Bidard FC ,et al. Elacestrant vs fulvestrant or aromatase inhibitor (AI) in phase III trial evaluating elacestrant, an oral selective estrogen receptor degrader (SERD), vs standard of care (SOC) endocrine monotherapy for ER+/HER2- advanced/metastatic breast cancer (mBC): Subgroup analysis from EMERALD.2022 ESMO.220P.
[14].Menarini Group’s Elacestrant Granted Priority Review by the U.S. FDA for Patients with ER+/HER2- Advanced or Metastatic Breast Cancer
[15].Lloyd MR, Wander SA, Hamilton E, Razavi P, Bardia A. Next-generation selective estrogen receptor degraders and other novel endocrine therapies for management of metastatic hormone receptor-positive breast cancer: current and emerging role. Ther Adv Med Oncol. 2022 Jul 30;14:17588359221113694.
[16].DUSTIN D, GU G, FUQUA S. ESR1 mutations in breast cancer[J]. Cancer, 2019, 125(21): 3714-3728.
[17].TOY W, SHEN Y, WON H, et al. ESR1 ligand-binding domain mutations in hormone-resistant breast cancer[J]. Nat Genet, 2013, 45(12): 1439-1445.
[18].ZHU W, REN C, WANG Y, et al. Prevalence of ESR1 mutation in Chinese ER-positive breast cancer[J]. Onco Targets Ther,2020, 13: 615-621.
[19].Liao H, Huang W, Pei W, Li H. Detection of ESR1 Mutations Based on Liquid Biopsy in Estrogen Receptor-Positive Metastatic Breast Cancer: Clinical Impacts and Prospects [J]. Front Oncol. 2020;10:587671.
[20].FREITAG C E, MEI P, WEI L, et al. ESR1 genetic alterations and their association with clinicopathologic characteristics in advanced breast cancer: a single academic institution experience[J]. Hum Pathol, 2021, 107: 80-86.
[21].ZHANG K, HONG R, XU F, et al. Clinical value of circulating ESR1 mutations for patients with metastatic breast cancer: a meta-analysis[J]. Cancer Manag Res, 2018, 10: 2573-2580.
[22].FRIBBENS C, O'LEARY B, KILBURN L, et al. Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast cancer[J]. J Clin Oncol, 2016, 34(25):2961-2968.
[23].TURNER N C, SWIFT C, KILBURN L, et al. ESR1 mutation and overall survival on fulvestrant versus exemestane in advanced hormone receptor-positive breast cancer: a combined analysis of the phase Ⅲ SoFEA and EFECT trials[J]. Clin Cancer Res, 2020, 26(19): 5172-5177.
*此文仅用于向医学人士提供科学信息,不代表本平台观点


| 留言与评论(共有 0 条评论) “” |