
撰文丨十一月
膜蛋白是许多重要生物学功能的关键,但又很容发生错误折叠,因此对膜蛋白进行分子质量控制是细胞和机体内稳态的重中之重【1】。错误折叠的膜蛋白的降解与发生在内质网上的降解过程(Endoplasmic reticulum–associated degradation,ERAD)相关【2】。内质网上的膜整合蛋白酶是信号肽酶复合体(Signal peptidase complex,SPC),这是内质网靶向信号的决定性酶,作用是切割N端信号肽【3】,这一功能被发现于上世纪七十年代。最近的研究表明,信号肽酶复合体也可以被病毒劫持促使蛋白成熟【4】,说明病毒能够利用信号肽酶复合体的某些固有活性,这表明信号肽酶复合体的作用不仅仅限于信号肽切割。
为了对信号肽酶复合体的其他的作用进行解析,德国慕尼黑工业大学Matthias J. Feige研究组与海德堡大学分子生物学中心Marius K. Lemberg研究组在Science合作发文题为The human signal peptidase complex acts as a quality control enzyme for membrane proteins,发现信号肽酶复合体SPC会作为膜蛋白质量控制因子发挥作用,有助于靶向错误折叠或者多余的蛋白质进行降解,从而确保膜蛋白质组的健康。

为了揭开信号肽酶复合体的底物范围,作者们对人类蛋白质组中包含非经典信号肽N端裂解位点的蛋白进行分析,从中共识别出了262种膜蛋白,其N端跨膜螺旋具有SPC裂解位点。作者们将关注点放在了空隙连接蛋白Connexin上,先前的体外实验表明具有信号肽类似加工过程。作者们将携带致病性突变的Cx32(Connexin 32)进行SDS聚丙烯酰胺凝胶电泳,发现存在两个条带,通过蛋白质表位标记的发现这是由于N端切割引起的。另外,SPC预测的切割位点以及SPC抑制剂会阻碍Cx32的切割加工。这些结果证实了信号肽酶复合体SPC的膜蛋白切割功能。
作者们发现,SPC对膜蛋白的这一切割加工功能并不是切割信号肽,因为信号肽是在生物合成的早期过程中被切割的,但是Cx32是在易位后才被加工的。作者们发现1297个人类膜蛋白存在N端SPC预测切割位点。作者们证实除了Cx32之外,中枢神经系统外环髓磷脂蛋白PMP22以及蛋白酶iRhom2也都能够被SPC进行切割。这些证据表明SPC的底物范围先前被大大低估了。
进一步地,作者们希望解决SPC切割加工是如何被调节的。先前进行的一项CRISPR筛选发现SPC中非催化亚基SPCS1与黄病毒多蛋白成熟相关,说明SPCS1可能是关键因子之一。作者们发现敲除SPCS1后,Cx32被切割的活性降低了50%。
与疾病相关的膜蛋白突变体被SPC切割可能表明其质量控制功能。因此,作者们推测错误折叠的膜蛋白可能会将隐藏的SPC裂解位点暴露,从而易于被切割。通过结构解析以及引入增加稳定性与破坏稳定性的突变,作者们发现Cx32膜蛋白的错误折叠会导致结构的解离,导致SPC裂解位点能够有效的被识别。
另外,作者们的数据发现SPC的切割与膜蛋白的错误折叠与组装相关,因此可能与内质网相关的膜蛋白降解ERAD过程存在联系。作者们发现SPC复合体在内源生理水平与Hrd1以及辅因子FAM8A1存在相互作用。进一步地,通过CHX处理,作者们发现Hrd1会清除SPC产生的Cx32切割片段。
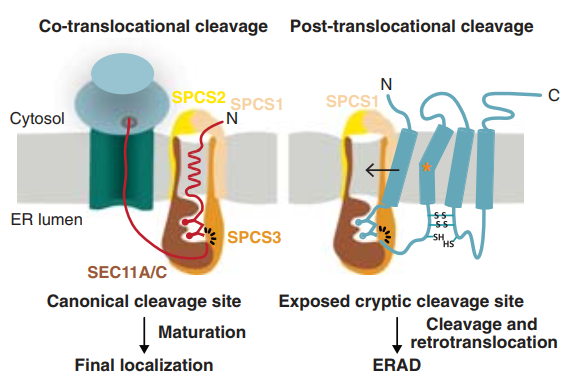
图1 工作模型
总的来说,作者们的工作显示信号肽酶复合体SPC的非经典膜蛋白质量控制作用。膜蛋白中隐匿的SPC切割位点,在蛋白质折叠以及组装发生错误的时会被暴露出来,成为预定的切割断点(图1)。SPC的质量控制活性有助于清除发生故障的蛋白,控制蛋白质组装并减轻内质网压力,提高细胞适应性。
原文链接:
http://doi.org/10.1126/science.abo5672
参考文献
1. J. T. Marinko et al., Chem. Rev. 119, 5537–5606 (2019).
2. M. K. Lemberg, K. Strisovsky, Mol. Cell 81, 2507–2519 (2021).
3. G. Blobel, B. Dobberstein, J. Cell Biol. 67, 835–851 (1975).
4. R. Zhang et al., Nature 535, 164–168 (2016)


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |