
撰文 | 雪月
责编 | 酶美
大多数人记忆T细胞是定位在组织内的,被称为组织驻留记忆T细胞tissue-resident memory T (TRM),是非循环性细胞。TRM通过定位在靶标细胞附近,对抗特异性感染或病毒感染,对机体提供最佳保护。TRM也能够在组织中发挥其他重要作用,通过对同源抗原或炎症信号作出响应参与组织保护和稳态维持。相对于循环记忆T细胞,TRM具有独特的转录谱,会表达促进组织驻留的整合素和归巢受体。CD103可以与上皮细胞的E-cadherin结合,屏障部位的大部分CD8+TRM细胞表达CD103,将TRM驻留在组织内。TRM以其独特的表型和对机体保护的重要性,是疫苗和免疫疗法的理想靶标。但是目前对TRM是否在组织中不可逆的存在以及二次感染对TRM迁移和寿命的影响尚不清楚。关于TRM稳定性和功能相关问题难以解答,是由于难以区分组织中真正驻留的TRM和外来浸润的非驻留型细胞。
近日,Science Immunology上发表了两篇关于肠道TRM细胞产生、二次感染后TRM细胞命运变化的文章:来自新泽西医学院的Tessa Bergsbaken 团队发表了题为CD103 fate mapping reveals that intestinal CD103−tissue-resident memory T cells are the primary responders to secondary infection的文章。

来自慕尼黑工业大学的Dietmar Zehn 团队发表题为Secondary infections rejuvenate the intestinal CD103+ tissue-resident memory T cell pool的文章。这两篇文章都对二次感染后肠道中CD8+TRM的异质性和功能特点以及记忆细胞库的扩增来源进行了分析。

这两项研究都使用了CD103-CreERT2 /flox-STOP-flox fluorescent reporters/OT-1 小鼠进行实验。作者用LCMV或者Yptb感染小鼠,之后将CD8+T细胞过继到未被感染的小鼠中。被过继细胞的小鼠进行LM-OVA, LCMV或者Yptb感染。分析肠道内的细胞发现谱系追踪的TRM数量上无明显变化,也不会扩增或者迁移出肠道。但是肠道内的CD103- CD8+T细胞明显扩增,并且会产生新的CD103+TRM。这表明CD103+TRM细胞在发生继发性感染时并不会促进T细胞库的扩增。作者又用CD103-CreERT2-DTR-floxed小鼠剔除CD103-T细胞,而CD103+TRM保持完整。分析发现二次感染后CD103+TRM仍没有发生扩增。这表明CD103+TRM缺乏扩增效应是内在特征,与其他细胞存在竞争无关。
接下来作者探索了CD103-细胞与原有CD103+细胞是否不同。作者首先分析了对抗原的反应性以及细胞因子表达差异。结果表明CD103-T细胞在感染后TCR-抗原相互作用明显,CD103+TRM则不明显。CD103+TRM会表现出GzmA高表达,CD103-T细胞高表达IFN-g。在二次感染前,CD103+TRM表达已知标志物归巢受体CCR9以及ITGAE CTLA4 GzmA等,而CD103-TRM表达迁移标志物CCR7 CCR2和S1PR1,表明其具有更高的增殖性和迁移性。二次感染后CD103-TRM的转录反应整体水平较高,细胞因子和趋化因子的表达水平较高,这表明CD103+TRM细胞对刺激的反应较为受限。作者认为CD103+CD8+TRM 可以以不依赖TCR和抗原的方式对组织感染进行监视。同时CD103+CD8+TRM组成型表达GzmA,对靶细胞进行裂解做好了准备。CD103+CD8+TRM通过整合素介导的粘附上皮细胞促进免疫突触的形成以及裂解细胞介质的释放,以靶向组织中受到感染的细胞。这些结果都表明,TRM的细胞定位以及相互作用需要不同的机制来介导免疫监视和组织保护。
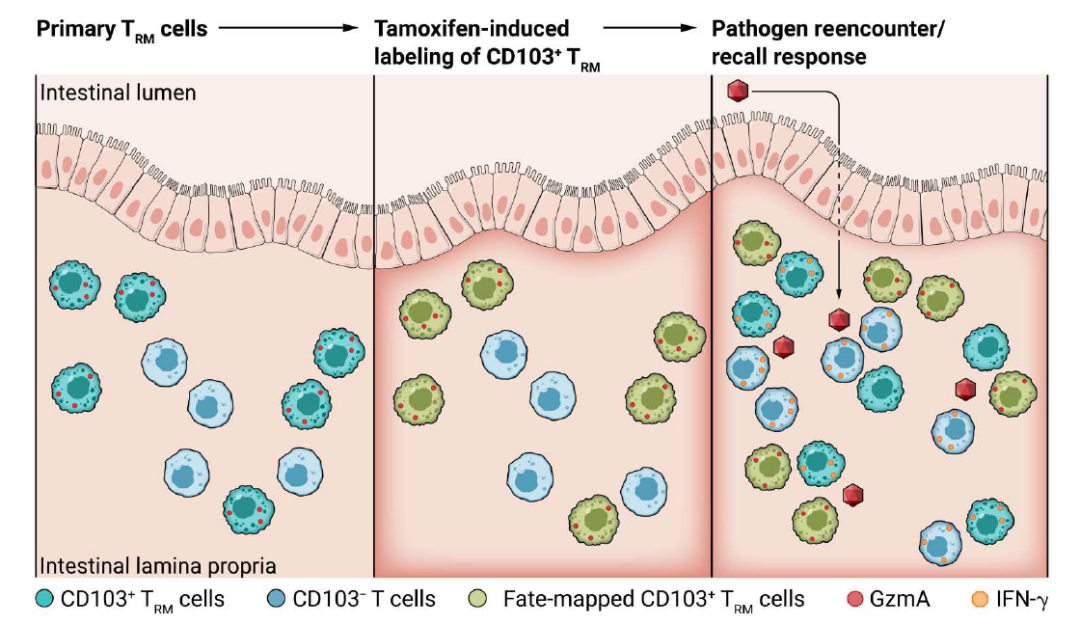
二次感染T细胞反应模式图
这两项研究揭示了对于TRM细胞异质性、功能以及细胞维持的新见解。CD103+CD8+TRM与驻留组织的关系更为紧密,以更好的作用于靶细胞,而CD103-TRM可以为补充和增加成熟TRM细胞库作出贡献。了解TRM不同功能反应亚群为疫苗接种策略和免疫调节疗法提供了更加全面的细胞基础。

来自哥伦比亚大学的Isaac J. Jensen 和Donna L. Farber合作为这两篇文章发表了题为Gutsy memory T cells stand their ground against pathogens的评论 文章。
原文链接:
1. http://doi.org/ 10.1126/sciimmunol.abl9925
2. http://doi.org/10.1126/sciimmunol.abp9553


想了解更多精彩内容,快来关注BioArt生物艺术
| 留言与评论(共有 0 条评论) “” |