
图片来源:pixabay
研究发现,在大脑发育的早期阶段,肠道微生物群有助于塑造大脑系统,这对于个体日后在生活中展现出社交技能至关重要。目前科学家已在鱼类中发现并证实了这种影响,分子和神经学证据似乎表明,同样的影响或许也会发生在人类身上。
编译 | 黄雨佳
审校 | 二七
近几十年来,科学家们已逐渐认识到,肠道和大脑间有着强大的相互影响。例如,某些类型的肠道溃疡与帕金森患者的症状恶化有关。临床医生也早已知道,胃肠道疾病在注意缺陷多动障碍(ADHD)和孤独症谱系障碍(ASD)等神经发育障碍的患者中更为常见。
美国纽约大学朗格尼健康中心(New York University’s Langone Health)的儿科胃肠病学家卡拉·马戈利斯(Kara Margolis)说,“不仅大脑对肠道有影响,肠道同样也可以深刻地影响大脑。”然而,这两个在解剖学上独立的器官究竟如何彼此影响,尚不清楚。
在今年11月初发表在PLOS Biology上的一篇论文中,研究人员发现,和肠道定植了微生物群的斑马鱼相比,那些缺少肠道微生物群的斑马鱼的社交能力要弱得多,而且它们的大脑结构也反映了这种差异。另一篇今年9月下旬发表在BMC Genomics的相关文章也描述了受肠道菌群影响的神经元分子特征。
美国俄勒冈大学(University of Oregon)的分子生物学家菲利普·沃什伯恩(Philip Washbourne)是这项新研究的主要研究人员之一,过去二十年来,他一直致力于研究与孤独症和社会行为发展相关的基因。他和他的实验室团队当时正在寻找一种新的模式生物,要求既要能表现出社会行为,繁殖起来又要比首选实验对象——小鼠——更快、更容易。“我们能在鱼身上做这项研究吗?”他回忆道,然后说,“我们对鱼量化试试,看看能否用某种参数衡量鱼的友好程度。”
无菌鱼的故事
斑马鱼早已被广泛用于遗传学研究,它们繁殖迅速,且天然就是群居生物,两周大后的斑马鱼会开始以4至12只为一组的鱼群形式游来游去。直到成年之前,斑马鱼都是透明的,因此研究人员不必解剖就能观察它们的内部发育情况,而这在哺乳动物模型(如小鼠)中是完全不可能的。
研究团队用于实验的胚胎来自缺乏肠道微生物群的“无菌”斑马鱼,这些小鱼孵化后,研究人员立即给其中一部分鱼接种了健康的肠道细菌混合物。剩下的鱼则在一周后才接种,因此这部分鱼在发育早期处于“无菌”阶段。
一出生就接种菌群的斑马鱼在大约15天大时如期开始聚群,而那些以无菌状态开始发育的斑马鱼“令人震惊地没有成群”,这项研究的作者之一,俄勒冈大学的神经科学家朱迪思·艾森(Judith Eisen)说道。即便这些鱼后续也接种了肠道微生物,它们还是无法达到和同龄鱼同样程度的社会性。
艾森、沃什伯恩和团队成员研究这些鱼的大脑,发现两组鱼的大脑结构间有明显差异。那些生命的第一周处于“无菌”状态的斑马鱼的一簇前脑神经元间显示出了更多相互连接,而这些神经元会影响鱼的社会行为。同时,这簇细胞中的小胶质细胞也明显减少。小胶质细胞是一种神经免疫细胞,负责清理大脑中的垃圾。艾森说,“这些是神经系统的重大改变。”
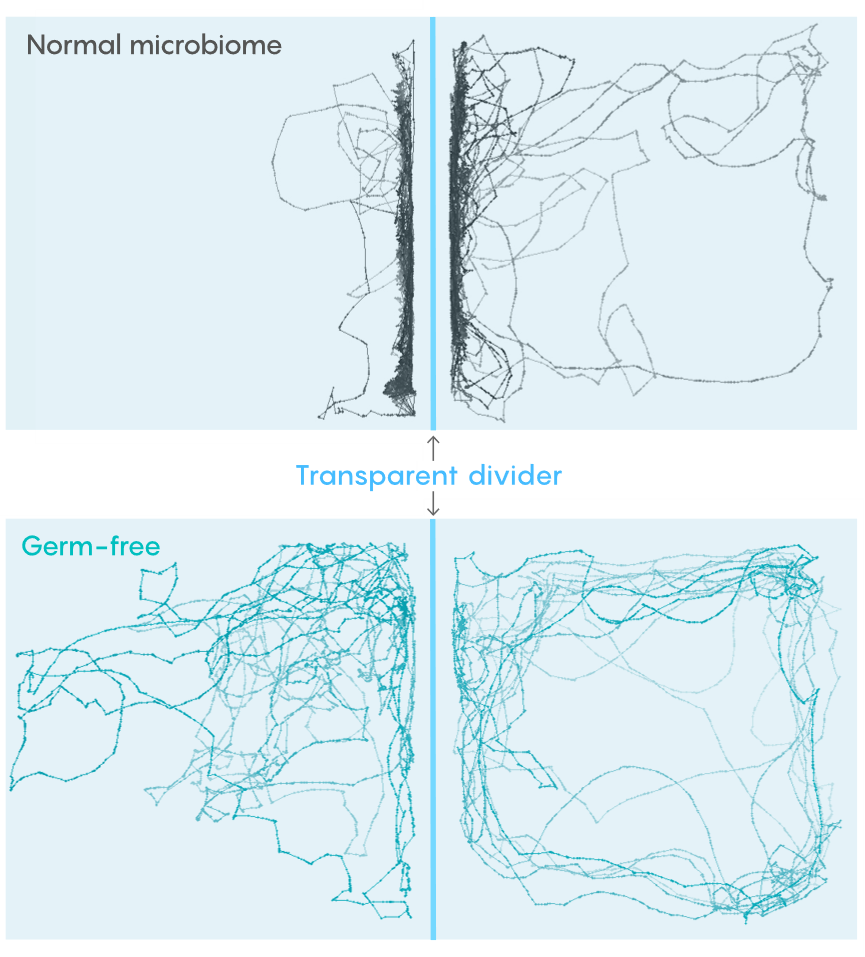
该研究团队猜测,健康的肠道微生物会以某种方式促进斑马鱼大脑中小胶质细胞的蓬勃发展。之后,在发育的特定关键时期,这些小胶质细胞就像园艺工人一样,修剪神经元上疯狂分支的“手臂”。如果没有小胶质细胞修剪这些分枝,鱼大脑中的社会神经元就会变得纠缠不清、过度生长,就像无人打理的灌木丛那样。
肠道微生物如何向发育中的大脑发送信号以产生这些影响尚不清楚。细菌能释放大量各种各样的化学物质,而理论上任何足够小的化合物都可以穿过血脑屏障。不过,也可能是免疫细胞在肠道和大脑之间游走的同时携带了信号分子,又或是某些信号沿着迷走神经由肠道向大脑传播。
其他群居动物的肠道微生物
同样的机制也可能在包括人类在内的其他脊椎动物中发挥作用。社群是动物世界中一种共同的生存策略。“这是一种在演化过程中被保留下来的行为,”美国加州理工学院(California Institute of Technology)的生物学家利维娅·赫克·莫赖斯(Livia Hecke Morais)这样说道。
今年11月发表在《微生物学前沿》上的一篇文章中,研究人员采集了波多黎各海岸附近圣地亚哥岛上一个恒河猴群体的粪便样本,并用互相梳毛的时长和伙伴个数作为社交能力的评估指标。研究发现一些对宿主免疫有益的细菌(如粪杆菌属、普氏菌属)在社交能力更强的恒河猴粪便中更多,而典型的致病菌属——链球菌在不善交际的恒河猴粪便中更为丰富。同时,一些在人类孤独症患者中减少的肠道细菌属在不善交际的猕猴中也更少。
不过,究竟是社交能力影响了猕猴的肠道微生物群,还是肠道微生物群反过来影响了社交能力,又或是二者相互影响,在这篇文章中并未阐明。但沃什伯恩和艾森之前在小鼠身上发现的与斑马鱼中几乎同样的社交神经元,或许意味着斑马鱼肠道菌群对社交能力的影响也可能以同样方式发生在哺乳动物中。沃什伯恩说,“如果你能在鱼和小鼠中找到相同类型的细胞,那么你也很可能会在人身上找到同样的细胞类型。”

然而,莫赖斯警告说,无论是斑马鱼或是小鼠,都无法完美地类比到人类身上。她说,鱼和小鼠的神经通路有点儿不同,并且这些物种都有各自不同的肠道微生物群,可能会释放不同的化学信号。
尽管如此,该原则可能广泛适用于不同的生物群体。艾森说,不同微生物产生的化学物质仍有可能影响斑马鱼、小鼠、人或其他动物大脑中的小胶质细胞数量。不过她也同意,将不同物种直接混为一谈是件很危险的事,模式生物“和人并不完全相同”。
肠道微生物群的多样性
未来,艾森、沃什伯恩和他们的研究团队希望能查明斑马鱼的肠道微生物究竟是怎样向大脑传递信号的。他们还想确定神经发育的敏感期有多长,以了解早期对肠道的干预是否能使大脑发育重回正轨。最终,他们希望这项研究能够使人们更深入地了解神经发育障碍是如何在人群中产生的,尽管这也许会很困难。
“问题在于这个猜想必须在人体中测试,” 马戈利斯说,“但这实行起来颇具挑战性。”设计一项对人类婴儿进行肠道干预的临床试验会很困难,因为孤独症谱系障碍等疾病通常要到患儿7岁或更大年龄才被诊断出来,这很可能是在干预幼儿并产生相应影响的关键窗口期关闭很久之后。
不过,一项于2017年在18名7至16岁的孤独症谱系障碍患儿中进行的临床试验表明,经过持续10周的微生物群转移疗法,通过口服或直肠给予一定剂量的标准化人类肠道微生物群,这些患儿的孤独症谱系障碍相关行为有了显著改善,并且在结束治疗的8周内未出现病情逆转。这或许提示这一干预的窗口期比人们预想的要长。
这项临床试验使用的标准化人类肠道微生物群由健康个体的粪便作为起始材料进行制备,但哪怕是同一物种,不同个体的微生物群也会有显著差别。两个在各方面看上去都完全一样的人,其肠道微生物群方面的差异也可能在70%以上。仅观察个体的微生物群也并不足以作为诊断神经发育障碍的依据,马戈利斯说,“并不存在一个微生物群是孤独症微生物群。”
对沃什伯恩来说,如果人类确实存在这样一个对肠道微生物敏感的发育时期,那么对其进行干预也几乎是不可能的,他说,“我并不认为我们离所谓的灵丹妙药更近了一步。”不过,哪怕只是能以某种微小的方式描述肠道对大脑影响,也有助于解开这极其复杂的人类之谜。他说,就目前而言,这已经足够了。
参考资料:
https://www.quantamagazine.org/the-gut-microbiome-helps-social-skills-develop-in-the-brain-20221115/
https://www.frontiersin.org/articles/10.3389/fmicb.2022.1032495/full
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-016-0225-7
转载内容仅代表作者观点
不代表中科院物理所立场
如需转载请联系原公众号
来源:环球科学

编辑:深浅
| 留言与评论(共有 0 条评论) “” |